研究内容の紹介
免疫システムの制御メカニズムを解明します
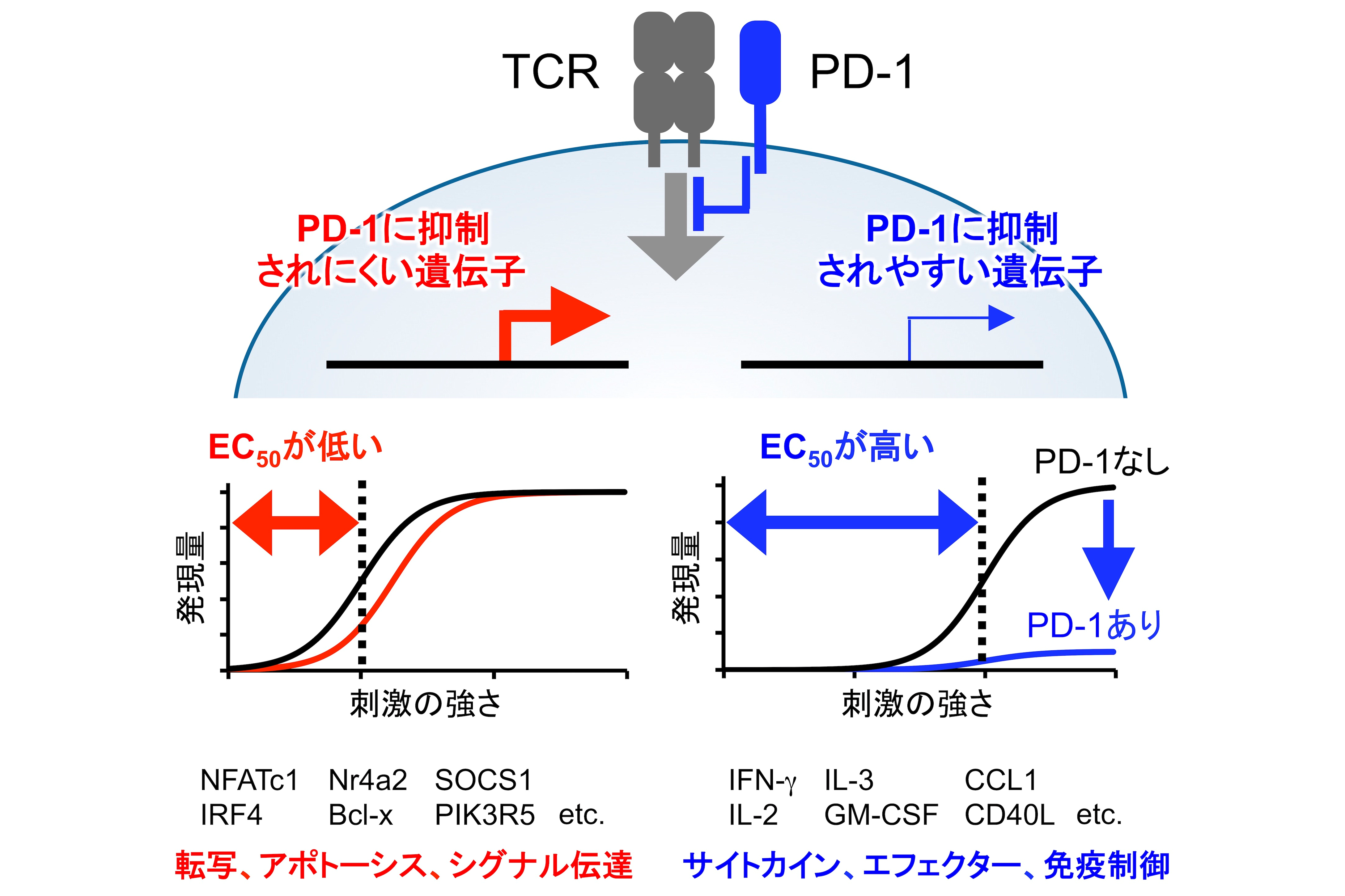
抑制性免疫補助受容体・PD-1およびCTLA-4の機能阻害によるがん免疫療法、いわゆる免疫チェックポイント阻害療法の成功により、未治療の状態でもがん細胞に対する免疫応答は既に誘導されているものの、PD-1およびCTLA-4により、がん細胞への攻撃力が無力化されていることが明らかになりました。さらに、PD-1やCTLA-4に対する阻害抗体を用いて、それまで体内で無力化されていたがん細胞特異的T細胞を活性化し、がん細胞を攻撃させることで、がんを治療できることが証明されました。これらの発見は、がん治療およびがん研究に大きな変革をもたらしました。一方、その奏効率は20〜30%と限られており、自己免疫疾患様の副作用も問題となっていることから、より効果的かつ安全な治療法の開発が求められています。
T細胞の活性化は、PD-1とCTLA-4以外にも数多く存在する免疫補助受容体および様々な免疫制御分子によって厳密に制御されています。PD-1阻害抗体の使用が認可されて以降、各種免疫補助受容体を標的とした薬剤の開発が世界中で精力的に進められていますが、各免疫補助受容体の機能がどのように異なり、使い分けられているのかといった根本的な問題でさえ、その多くが解決されていません。当研究分野では、免疫補助受容体の研究を中心に、免疫システムの制御メカニズム全貌の解明を目指して研究を進めています。免疫制御メカニズムの全貌が解明されることにより、免疫応答を自在に操作して様々な疾患を治療する方法が開発できると期待しています。


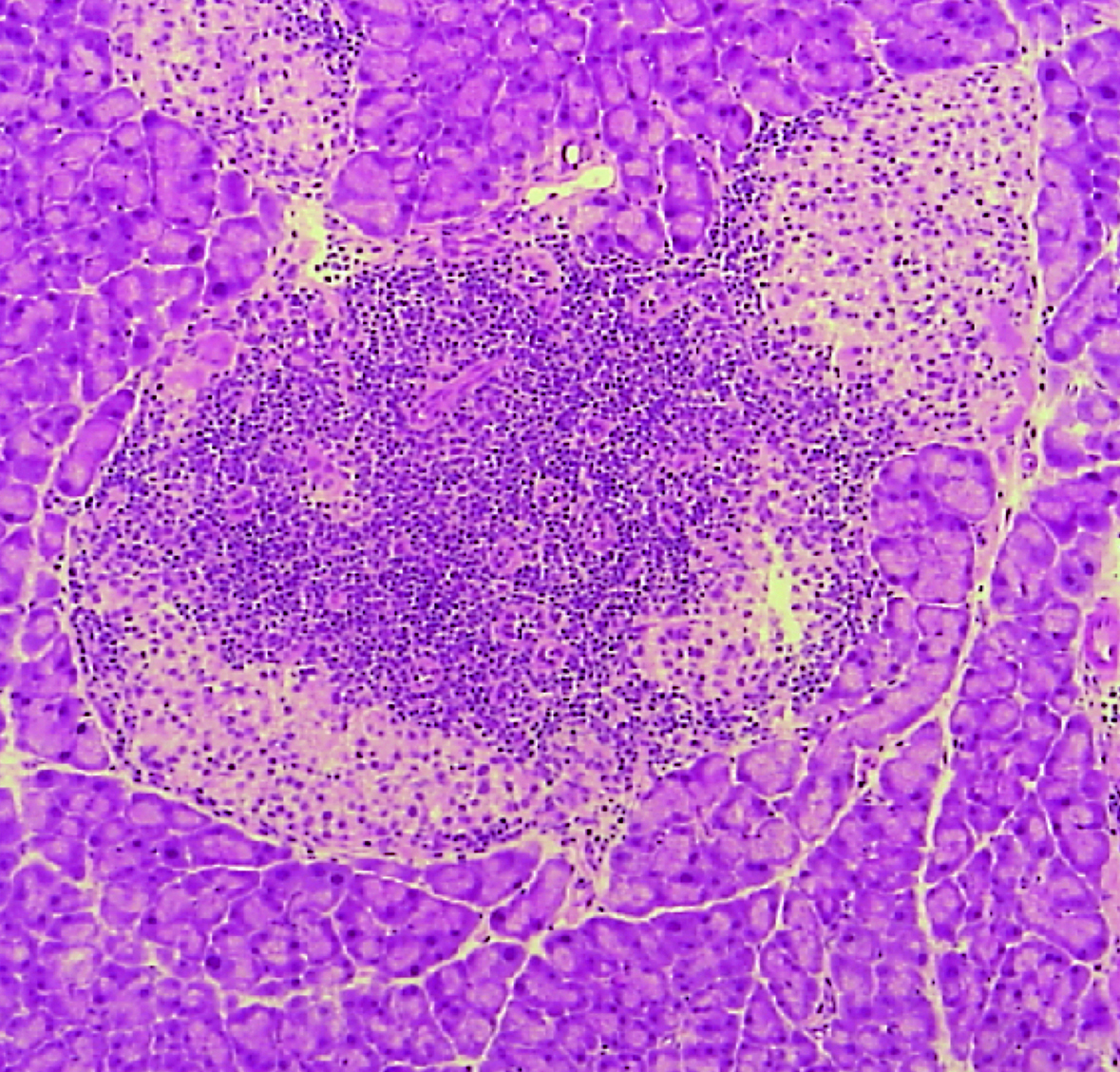
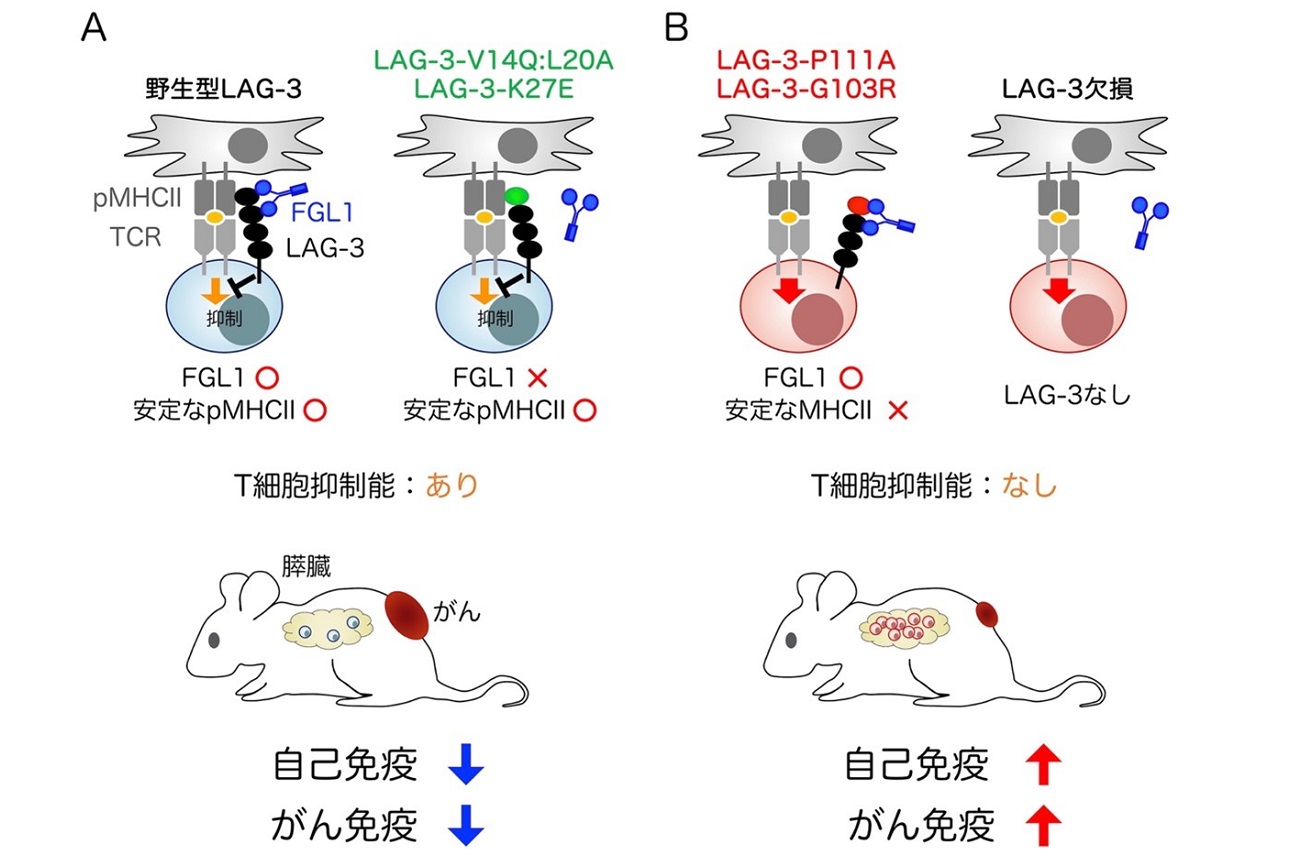
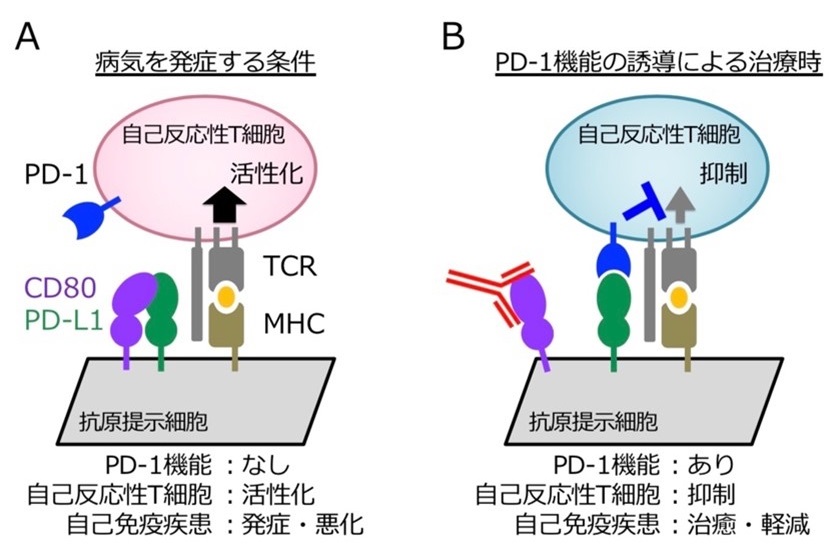
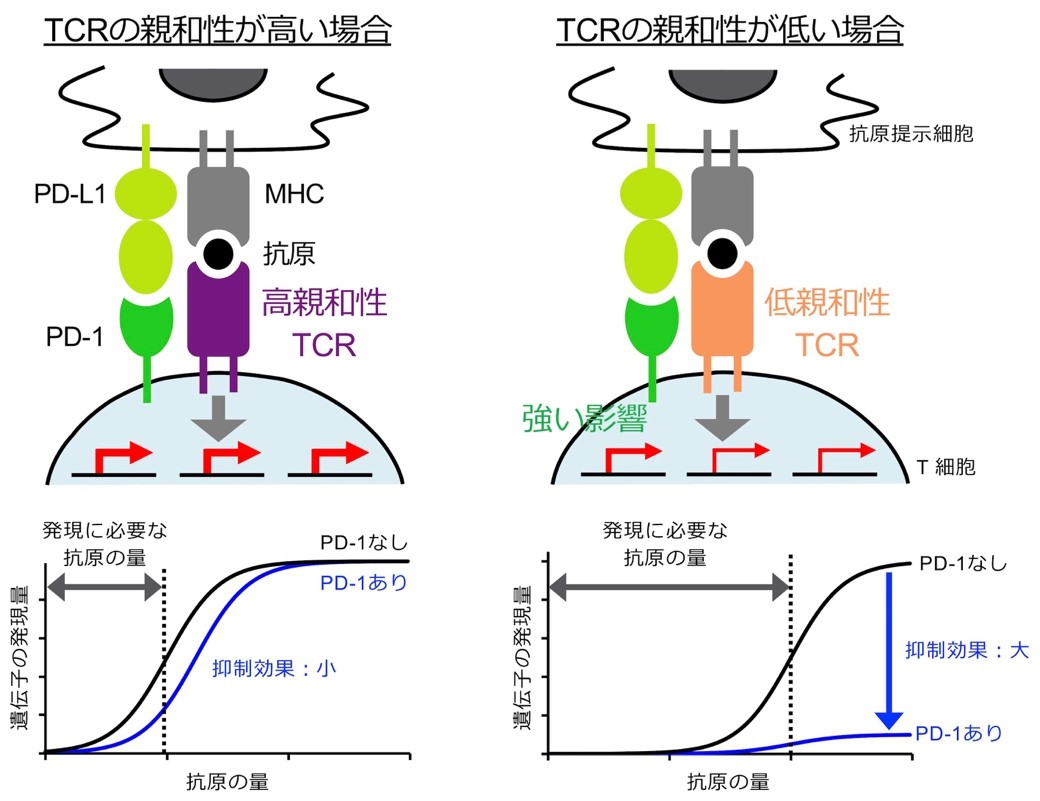









B:PD-1はPD-L1と結合することによりT細胞の活性化を抑制しますが(左)、CD80とPD-L1のシス結合によりPD-1とPD-L1の結合が妨害され、PD-1の機能が阻害されます(中)(杉浦ら, Science, 2019)。CD80をPD-L1から引き剥がし、PD-1の機能阻害を解除する方法が、自己免疫疾患の治療に有効であることを最近明らかにしました(右)(杉浦ら, Nat Immunol, 2022)。