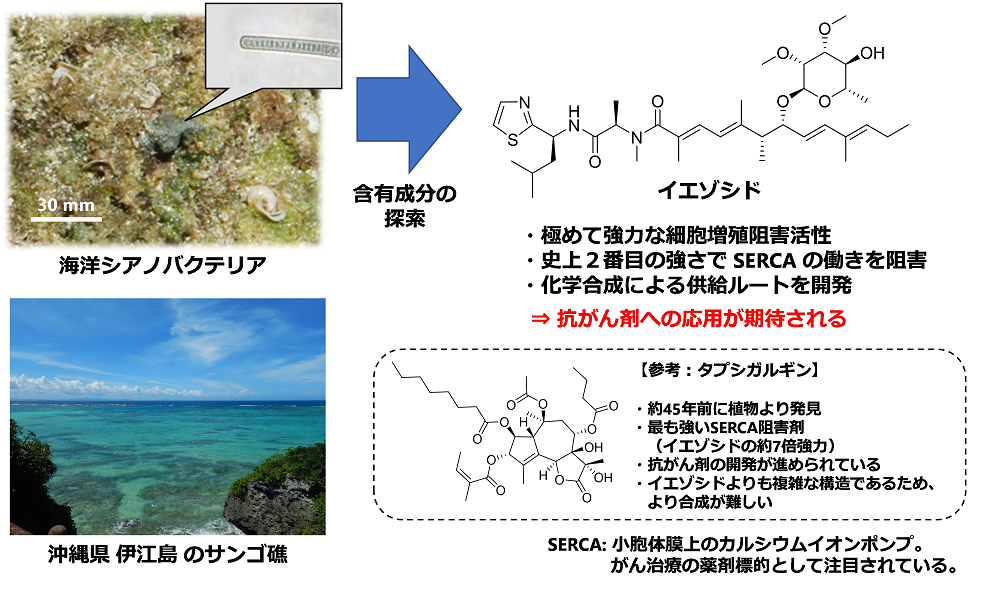
研究内容の紹介
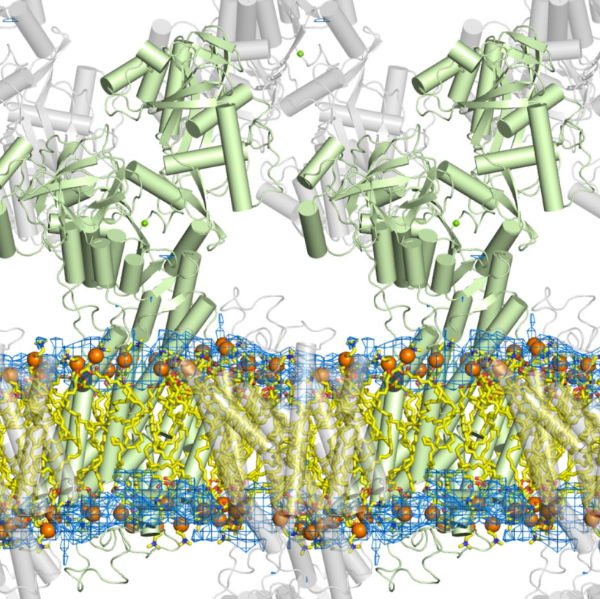
膜輸送体の機能をその原子構造から理解する
蛋白質はその構造を変化させて機能しているのですから、立体構造情報無しに生命現象を理解することは不可能です。本研究分野では、X線結晶解析を主要な手段として生理的に重要な膜蛋白質の原子構造に基づく機能の解明を目指しています。中心課題は、イオン能動輸送機構の構造的実体の解明です。筋肉の弛緩を担うカルシウムポンプに関しては、2000年にイオンポンプとして最初の結晶化に成功して以来、全反応過程をほぼカバーする10個の状態での結晶構造を決定しました(文献1-4)。ポンプ蛋白質を取り巻く脂質二重膜の可視化にも成功しました(文献5)。この結果、イオンポンプのメカニズムの大略は原子構造に基づいて理解できたともいえます。しかし結晶構造は反応過程の幾つかの点を表しているに過ぎないし、X線では見えないプロトンが構造変化や機能発現に重要な役割を果たすことがわかってきました(文献8)。そのため、理論計算を取り入れた構造研究を行っています。また、高等動物細胞による発現系を用いて変異体の結晶構造解析にも成功していますが(文献8, 9)、そのような技術は独自のものであり今後ますます重要になるでしょう。もう一つの主要な研究対象はナトリウム・カリウムポンプで(図)、デンマークグループと共同研究を行っています(文献6, 7, 10)。このポンプはジギタリスに代表される強心剤の標的ですが、全ての動物細胞に発現しており、より複雑で高血圧や多くの神経疾患にも深く関わっており、カルシウムポンプ以上に重要な蛋白質です。イオンポンプは生体の恒常性維持に必須であり、その攪乱は細胞死につながるため病原菌やがん細胞を攻撃する良い標的としても注目されています。一連の研究は国際的に高く評価され、既に多くの教科書に紹介されているほか、豊島教授は名誉ある米国科学アカデミー外国人会員,カリフォルニア大学バークレー校のヒッチコック教授に選出されています(インタビューと講義はYouTubeで見ることができます)し、2009年度の朝日賞、2015年度紫綬褒章、2016年度Gregori Aminoff賞、2018年度恩賜賞・日本学士院賞を授与されました。