研究分野の概略
肝臓や膵臓の発生メカニズムの理解と各種構成細胞の分離・培養技術を基盤として、ヒトiPS細胞から機能的な肝臓や膵臓の組織を分化誘導・構築する培養系の開発を進めることで、再生医療や創薬に貢献します。
研究内容の紹介
発生原理の理解にもとづく、ヒトiPS細胞からの肝臓・膵臓の細胞分化誘導と組織構築
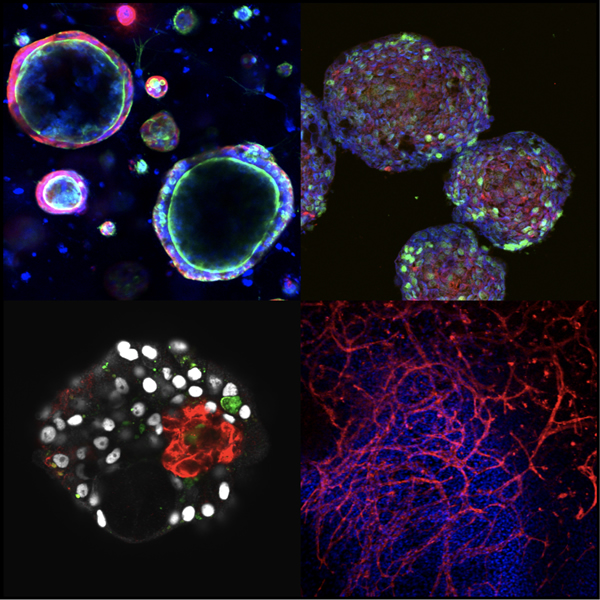
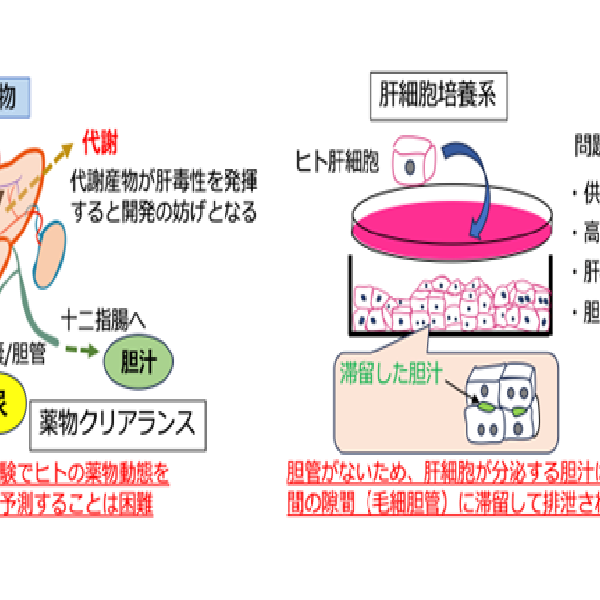
iPS細胞を使った再生医療や創薬研究には、細胞分化誘導系および組織構築系の開発が必須です。肝臓は代謝や解毒の中心器官であり、その諸機能を担う肝実質細胞(肝細胞)は、胎児期の肝前駆細胞(肝芽細胞)より発生します。肝芽細胞は、内皮細胞や間葉系細胞と共に肝臓原基を形成し、それら細胞間での有機的な相互作用をつうじて機能的に成熟した肝臓が形作られます。当研究室では、肝芽細胞をはじめ肝臓を構成する各種細胞を同定・分離・培養するシステムを開発し、それらの性状や細胞間相互作用の分子的実態の解析を行うことで、肝臓の発生メカニズムの解明に取り組んできました。こうした知見にもとづき、肝臓の発生過程を模倣することで、ヒトiPS細胞から機能的な肝臓の細胞分化・組織構築を実現する培養系の開発を行っています。同様に、ヒトiPS細胞からインスリン産生細胞を含む膵島様構造体を構築することにも成功しています。こうしたiPS細胞からの細胞分化・組織構築の技術を用いてin vitro病態モデルの開発や創薬研究を行うとともに、再生医療への展開を目指しています。
論文一覧
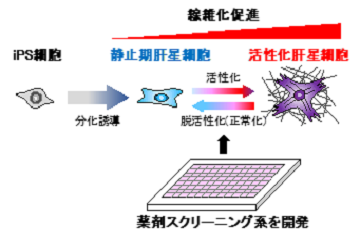
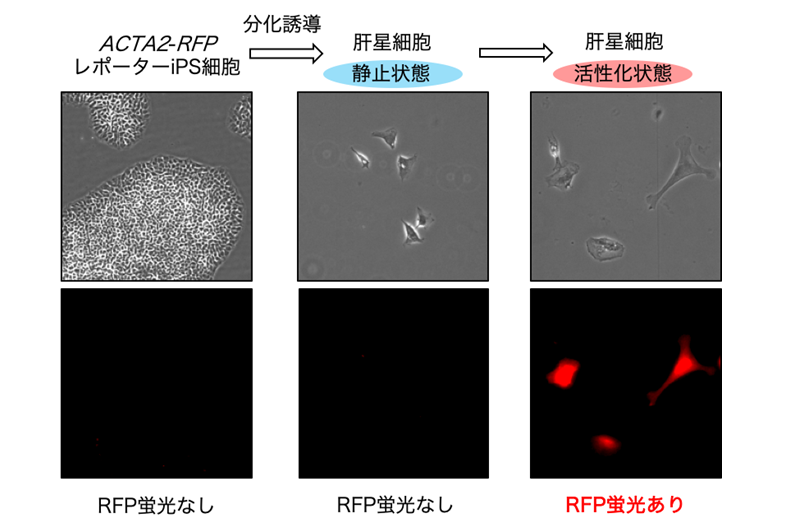
- Nakano Y, Saijou E, Itoh T, Tanaka M, Miyajima A, Kido T. Development of a high throughput system to screen compounds that revert the activated hepatic stellate cells to a quiescent-like state. Sci Rep. 2024. doi: 10.1038/s41598-024-58989-6.
- Koui Y, Kido T. Using human induced pluripotent stem cell-derived liver cells to investigate the mechanisms of liver fibrosis in vitro. Biochem Soc Trans. 28;51(3):1271-1277. 2023. doi: 10.1042/BST20221421.
- Himeno M, Chen SW, Kido T. Co-culture model for hepatitis B virus infection using. iPSC-derived liver progenitor cells and liver sinusoidal endothelial cells. Methods Mol Biol 2544:107-117. 2022. doi: 10.1007/978-1-0716-2557-6_7.
- Koui Y, Himeno M, Mori Y, Nakano Y, Saijou E, Tanimizu N, Kamiya Y, Anzai H, Maeda N, Wang L, Yamada T, Sakai Y, Nakato R, Miyajima A, and Kido T. Development of human iPSC-derived quiescent hepatic stellate cell-like cells for drug discovery and in vitro disease modeling. Stem Cell Rep. 16, 3050–3063, 2021. https://doi.org/10.1016/j.stemcr.2021.11.002
- Watanabe A, Tanaka A, Koga C, Matsumoto M, Okazaki Y, Kin T, and Miyajima A. CD82 is a marker to isolate β cell precursors from human iPS cells and plays a role for the maturation of β cells. Sci Rep. 2021 May, 11: 9350. https://doi.org/10.1038/s41598-021-88978-y
- Naoki Tanimizu, Norihisa Ichinohe, Yasushi Sasaki, Tohru Itoh, Ryo Sudo, Tomoko Yamaguchi, Takeshi Katsuda, Takafumi Ninomiya, Takashi Tokino, Takahiro Ochiya, Atsushi Miyajima, and Toshihiro Mitaka. Generation of functional liver organoids on combining hepatocytes and cholangiocytes with hepatobiliary connections ex vivo. Nature Comm. 2021 Jun 7;12(1):3390. doi: 10.1038/s41467-021-23575-1
- Kamimoto K, Nakano Y, Miyajima A, and Itoh T. Multidimensional imaging of liver injury repair in mice reveals fundamental role of the ductular reaction. Communications Biology (2020) 3: 289. https://doi.org/10.1038/s42003-020-1006-1
- Itoh T and Miyajima A. Filling a gYap in Hepato-Biliary Tissue Integration in Liver Homeostasis and Regeneration. Cell Stem Cell. 2019 Jul 3;25(1):5-6. doi: 10.1016/j.stem.2019.06.006.
- Miura Y, Matsui S, Miyata N, Harada K, Kikkawa Y, Ohmuraya M, Araki K, Tsurusaki S, Okochi H, Goda N, Miyajima A. and Tanaka M. Differential expression of Lutheran/BCAM regulates biliary tissue remodeling in ductular reaction during liver regeneration. eLife 2018; 7: e 36572. Doi :10.7554/eLife.36572
- Saijou E, Enomoto Y, Matsuda M, Kok C, Akira S, Tanaka M and Miyajima A. Neutrophils alleviate fibrosis in the CCl4-induced mouse chronic liver injury model. Hepatology Communications.2, 703-717, 2018. DOI 10.1002/hep4.1178
宮島 篤 特任教授
MIYAJIMA Atsushi
理学博士
木戸 丈友 特任准教授
KIDO Taketomo
博士(農学)