発表概要
発表のポイント
◆放射線などによって切断された二本鎖DNA の修復に中心的な役割を担うタンパク質RAD51 が、染色体上で二本鎖DNA 切断を検知して修復を開始する様子を明らかにしました。
◆RAD51 の染色体への結合には、がん患者において変異が多数報告されているRAD51 のアミノ末端領域が重要であることを発見しました。
◆本研究は、RAD51 の機能不全を原因とするがん発症メカニズムの解明に貢献することが期待されます。
発表内容
東京大学大学院理学系研究科大学院生の塩井琢郎、同大学定量生命科学研究所クロマチン構造機能研究分野教授の胡桃坂仁志らの研究グループは、DNA 修復タンパク質RAD51 がクロマチン中でDNA の二本鎖切断を見つけ出し、DNA 修復を進行するメカニズムを明らかにしました。
[研究の背景]
生物の設計図であるゲノムDNA は、紫外線や細胞の代謝などによって日常的にDNA 損傷(注1)を受けています。特に、放射線などにより生じる二本鎖切断は発がんの原因となる重篤なDNA損傷であり、RAD51 によって正確に修復される必要があります。一方で、ヒトを含む真核生物の染色体では、ゲノムDNA はヌクレオソーム(注2)が連なったクロマチンを形成しています。ヌクレオソームはヒストン複合体にDNA が強固に巻きついた構造であり、RAD51 による二本鎖切断修復の立体的な妨げになります。従って、切断された染色体上のDNA にRAD51 がどのように結合し、DNA 修復を進行するか、そのメカニズムは不明でした(図1)。
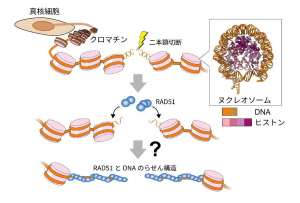
図1:RAD51 による染色体上でのDNA の二本鎖切断修復
ヒトを含む真核生物のゲノムDNAは、ヌクレオソームを基本構造としたクロマチン構造を形成しています。ゲノムDNAに二本鎖切断が生じた後、DNA上にRAD51 が集積してDNA 修復を進行させます。
[研究内容]
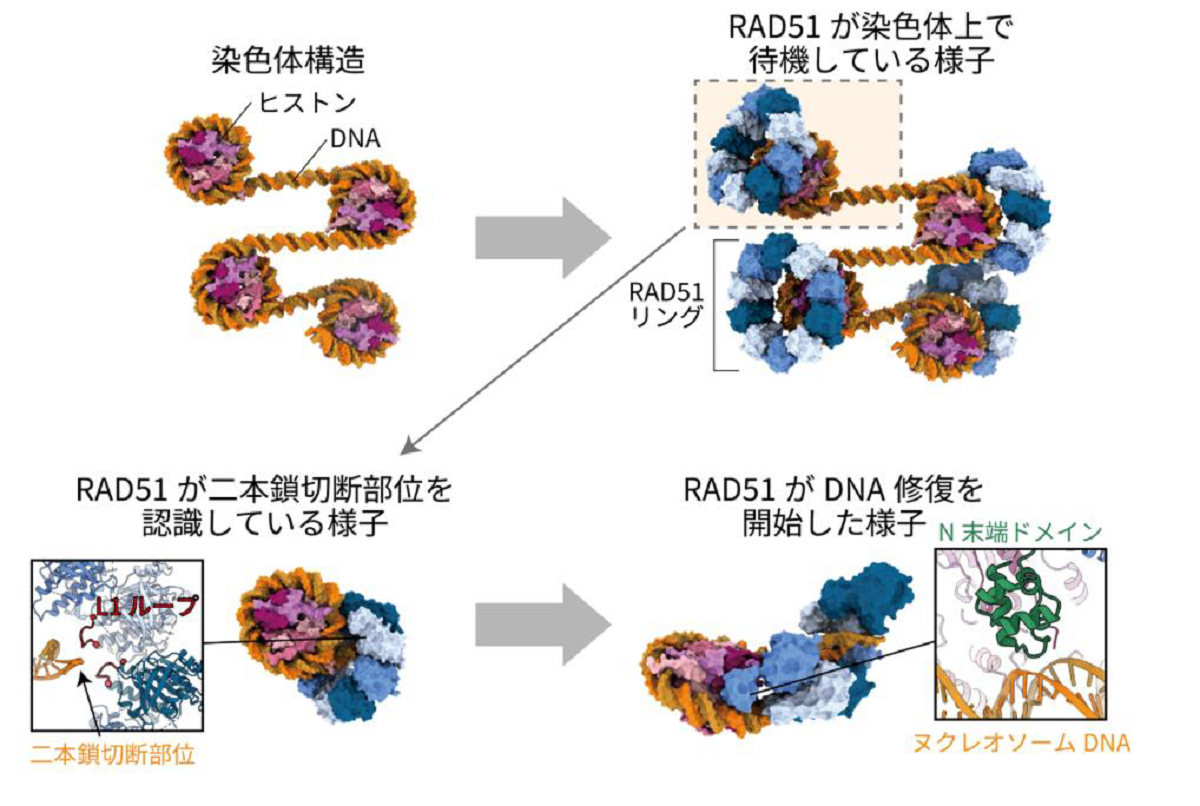
本研究では、ヒトRAD51 とヌクレオソームからなる複合体の構造をクライオ電子顕微鏡 (注3)により解析しました。その結果、RAD51 がリング状の構造を形成してヌクレオソームに結合すること、さらにRAD51 がヌクレオソームからDNA を引き剥がしながららせん状の構造を形成するという画期的な発見をしました(図2)。これらは、RAD51 の染色体上への集積、損傷部位への結合、DNA 修復の開始という3 つの過程に対応している構造であると考えられます(図3)。また、機能未知であったRAD51 のアミノ末端ドメイン(以下、N 末端ドメイン)(注4)が、RAD51とヌクレオソームの結合に重要であることが明らかになりました(図2)。RAD51 のN 末端ドメインは、クロマチン構造を持たない細菌のRecA(RAD51 相同体)には存在せず、クロマチン構造を持つ真核生物にのみ保存された領域です。従って、RAD51 のN 末端ドメインは、ヌクレオソームに巻き取られたDNA の二本鎖切断を検知するために、進化の過程で真核生物のみが獲得したドメインであることが明らかになりました。RAD51 のリング構造においては、二本鎖切断の修復の活性中心であるL1 ループ領域(注5)を介して、二本鎖切断部位を検知していました(図2 b 右)。
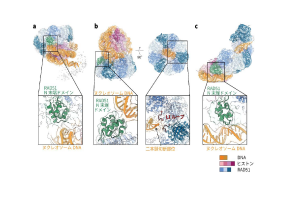
図2:RAD51 がヌクレオソームに結合した構造
(a)RAD51 が染色体上で待機している様子。(b)RAD51 が染色体上の二本鎖切断を認識している様子。(c)RAD51が染色体上でDNA 修復を開始した様子。(b)ではL1 ループ領域が、二本鎖切断部位と結合していました。
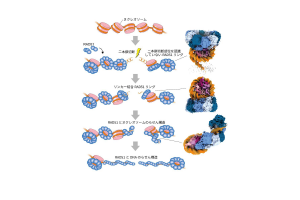
図3:RAD51 が染色体上でDNA の二本鎖切断を修復するモデル
RAD51は染色体上でリング構造で結合して待機し、さらに二本鎖切断の認識に機能します。その後、RAD51 はヌクレオソームからDNA を引き剥がしながららせん構造を形成することで、二本鎖DNA 切断の修復を進行します。右列の3 つの構造は、図2 で示したRAD51 とヌクレオソームの複合体の構造に対応しています。
[今後の展望]
今回、ヌクレオソーム結合への重要性が明らかになったRAD51 のN 末端ドメインには、多くのがん患者でアミノ酸の変異が複数見つかっています。本研究によって、RAD51 のN 末端ドメインの変異によってRAD51 とヌクレオソームの結合に支障が生じ、二本鎖切断が適切に修復されないことが発がんの原因となることが示唆されました。したがって本研究は、がん発症のメカニズム解明や、治療法の確立に貢献することが期待されます。
アイキャッチ画像
雑誌名等
雑誌名:Nature
題 名:Cryo EM structures of RAD51 assembled on nucleosomes containing a DSB site
著者名:Takuro Shioi(塩井琢郎), Suguru Hatazawa(畠澤卓), Eriko Oya(大屋恵梨子), Noriko Hosoya(細谷紀子), Wataru Kobayashi (小林航), Mitsuo Ogasawara (小笠原光雄), Takehiko Kobayashi (小林武彦), Yoshimasa Takizawa (滝沢由政), and Hitoshi Kurumizaka(胡桃坂仁志)*(*は責任著者)
DOI: 10.1038/s41586-024-07196-4
URL: https://doi.org/10.1038/s41586-024-07196-4
研究助成
本研究は、日本学術振興会(JSPS)の科研費「クライオ電子顕微鏡によるネイティブなセントロメアクロマチンの立体構造解析(代表:滝沢由政、JP22K06098)」、「p300によるヒストンアセチル化伝搬機構の構造生物学的解析(代表:畠澤卓、JP23K14134)」、「クロマチンにおけるDNA修復機構の構造基盤の解明(代表:胡桃坂仁志、JP23H05475)」と、日本医療研究開発機構(AMED)の生命科学・創薬研究支援基盤事業(BINDS)「エピジェネティクスの基盤原理解明と創薬のためのヒストンおよび再構成クロマチンの生産(代表:胡桃坂仁志、JP23ama121009)」、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト(研究総括:胡桃坂仁志、JPMJER1901)」の支援により実施されました。
用語解説
(注1)DNA損傷
塩基の酸化や塩基同士の異常な結合、DNA切断など、ゲノムDNA配列に影響を及ぼす様々な損傷。二本鎖切断はDNA の両方の鎖が切断される損傷であり、X線などの電離放射線、環境物質、DNA複製のエラーなどによって生じます。DNA損傷はがんや遺伝病といった重篤な疾患の原因となり、生物は損傷を正確に修復する仕組みを持っています。
(注2)ヌクレオソーム
クロマチンの基本単位であり、4 種類のヒストン(H2A、H2B、H3、H4)をそれぞれ2分子ずつ含んだヒストン8 量体に、約150 塩基対のDNAが巻き付いた構造体です。
(注3)クライオ電子顕微鏡
タンパク質を含む試料を極低温環境下で凍結し、閉じ込めた試料を電子線で観察する顕微鏡です。大量の画像を撮影することで、多様な角度情報を持つ粒子像を得ることができ、その情報から試料の立体構造を再構成できます。
(注4)アミノ末端ドメイン(N末端ドメイン)
タンパク質のアミノ基のある末端側の領域で、タンパク質合成において始めに合成される領域。RAD51は2つの球状ドメインで構成されており、アミノ末端側に存在する球状ドメインとRecAと相同な球状ドメインがあります。
(注5)L1ループ領域
RAD51のRecAと相同な球状ドメインに存在する領域で、直鎖状のDNAとの結合に重要であることが分かっています。
問い合わせ先
東京大学定量生命科学研究所
教授 胡桃坂 仁志(くるみざか ひとし )







