発表概要
【ポイント】
- 細胞内で折りたたまれたDNA(ヌクレオソーム)内の損傷を、読み取り装置(RNAポリメラーゼII)が検出する様子を、クライオ電子顕微鏡によって明らかにした。
- DNA損傷の位置の違いによって、ヌクレオソームの構造が変化し、下流の修復経路が決定されるというメカニズムを提唱した。
- DNA損傷を下流の異なる損傷修復の経路に導くことで、複数の方法で細胞のがん化を防いでいると考えられる。
東京大学定量生命科学研究所の大角健 氏、胡桃坂仁志 教授らの研究チームは、ヌクレオソーム(注1)により折りたたまれたDNA上の損傷が検出され、その損傷部位に応じて下流の異なる修復経路に受け渡される仕組みを解明しました。
ヒトのゲノムDNAはヌクレオソームと呼ばれる構造を形成することで、細胞核にコンパクトに折りたたまれています。これまで、ヌクレオソーム中のDNAに損傷が引き起こされたときに、どのように検出され、修復がなされるのかは不明でした。本研究では、クライオ電子顕微鏡(注2)を用いて、DNA読み取り装置であるRNAポリメラーゼII(注3)が、ヌクレオソームによって折りたたまれたDNA上の損傷を検出する様子を明らかにしました。さらに、この解析結果から、DNA損傷位置の違いがヌクレオソームの構造を変化させ、下流の修復経路を決定するという新しいメカニズムを提唱しました。本研究から明らかになったDNA損傷の検出および修復機構は、細胞のがん化を防ぐ仕組みの理解につながることが期待されます。
発表内容
【研究の背景・先行研究における問題点】
ヒトを含む真核生物のDNAは、ヌクレオソームと呼ばれる円盤状の構造に折りたたまれています(図1)。ヌクレオソームは、ヒストンタンパク質の周囲にDNAが巻き付いた構造体で、DNAをコンパクトに折りたたみます。

図1. DNAの折りたたみ構造のイメージ図
ヒトを含む多細胞生物のDNAは、ヌクレオソームと呼ばれる構造体を形成して細胞核内に収容されている。このDNA折りたたみ構造の基本単位であるヌクレオソームは、ヒストンタンパク質にDNAが巻き付いた構造体である。
ヒトなどの哺乳類では、このヌクレオソーム構造の形成により、全長2メートルにも及ぶ長大なDNAを直径約5ミクロンの細胞核に収容することができています。ヌクレオソームにより折りたたまれたDNAは遺伝子をコードしているため、適切なタイミングで読み取り装置であるRNAポリメラーゼIIによって読み取られなければなりません。興味深いことに、RNAポリメラーゼIIは、遺伝子上に生じたDNA損傷を検知して停止し、その後、停止したRNAポリメラーゼIIに、多くの修復タンパク質が集積してDNA修復マシナリーが形成することが知られていました。しかし、ヌクレオソーム中のDNAに損傷が生じた場合、どのようにRNAポリメラーゼIIが損傷で停止して、そして下流の修復因子を集積させるのかは明らかにされていませんでした。
【研究内容】
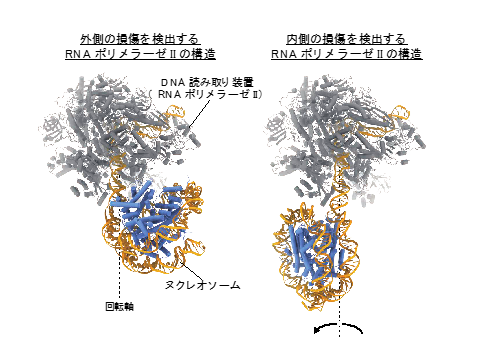
本研究では、クライオ電子顕微鏡を用いたタンパク質-DNA分子の立体構造解析により、DNA読み取り装置であるRNAポリメラーゼIIが、ヌクレオソーム中のDNA損傷を検出している最中の様子を、スナップショット構造として明らかにしました。研究チームは、DNA損傷を含んだヌクレオソームを再構成し、精製したRNAポリメラーゼIIによってDNAを読み取らせる反応(転写反応)を試験管内で行いました。その結果、RNAポリメラーゼIIがヌクレオソーム中のDNA損傷を検出して停止することを見出しました。この反応試料をクライオ電子顕微鏡で撮影し、コンピューターを用いた解析によりヌクレオソーム中で停止したRNAポリメラーゼIIの立体構造を明らかにしました。その結果、損傷の位置の違いが、RNAポリメラーゼIIに対するヌクレオソームの相対的な向きを決定していることを明らかにしました(図2)。この発見により、ヌクレオソームの向きの違いが、下流で機能するDNA損傷因子群のRNAポリメラーゼII上への集積の制御を行うという新しい概念を提唱することができました。
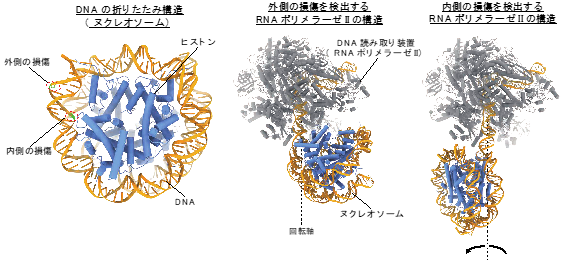
図2. DNA読み取り装置(RNAポリメラーゼII)がヌクレオソーム中のDNA損傷を検出する様子
(左)真核生物のDNAの折りたたみ構造であるヌクレオソームの構造モデル。ヌクレオソームはヒストンタンパク質にDNAが1.7回転巻き付いた構造をとる。ヌクレオソームの外側、内側それぞれの損傷を持つDNAを用意した。(中央)クライオ電子顕微鏡による解析から明らかになった、ヌクレオソームの外側に位置するDNA損傷を検出する際のRNAポリメラーゼIIの立体構造。(右)ヌクレオソームの内側に位置するDNA損傷を検出する際のRNAポリメラーゼIIの立体構造。DNA損傷のわずかな位置の違いが、ヌクレオソームの向きに大きな影響を与える。このことから、損傷を検出した下流の損傷修復経路が異なる可能性が示唆された。
【社会的意義・今後の展望】
ヒトを含む多細胞生物のゲノムDNAは、ヌクレオソームによって折りたたまれています。本研究から得られた知見は、ヌクレオソーム中のDNA損傷がどのように検出され、修復されるのかという問題への一つの答えを示しています。加えて、今回新たに行った、転写伸長に伴うヌクレオソーム分子の立体構造の変化を、クライオ電子顕微鏡によって可視化するという方法論が、今後のDNAに関連した反応における新たな知見を創出する基盤技術を提供すると考えられます。
DNAの損傷修復が正常になされない場合、突然変異が生じ、がん化へとつながります。ヌクレオソーム中のDNA損傷とがん化の関係はこれまでも示唆されてきましたが、本研究から、ヌクレオソーム中のDNAの損傷位置によってDNA損傷修復機構が異なることを示唆されました。将来的に、この立体構造を標的とした治療法や創薬方法の開発が期待されます。
研究助成
本研究は主に、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクスの基盤原理解明と創薬のためのヒストンおよび再構成クロマチンの生産」(代表:胡桃坂仁志、JP22ama121009)と日本学術振興会(JSPS)の基盤研究(S)「クロマチンにおけるDNA修復機構の構造基盤の解明」(代表:胡桃坂仁志、23H05475)、新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」(代表:胡桃坂仁志、JP18H05534)、基盤研究(B)「転写と共役したヌクレオソーム再構築の分子メカニズムの解明」(代表:江原晴彦、JP20H03201)、基盤研究(S)「転写と中核的な生命機能を結びつける高次複合体の構造基盤」(代表:関根俊一、JP20H05690)、基盤研究(C)「クライオ電子顕微鏡によるネイティブなセントロメアクロマチンの立体構造解析」(代表:滝沢由政、JP22K06098)、若手研究「クロマチン構造における自然免疫制御機構の解明」(代表:鯨井智也、JP22K15033)、基盤研究(A)「クロマチン上で起こる転写と共役した二重鎖切断修復の分子機構の解明」(代表:胡桃坂仁志、JP20H00449)、基盤研究(B)「液-液相分離を基盤としたDNA二重鎖切断修復機構の解明」(代表:香川亘、JP22H03743)、および国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(研究総括:胡桃坂仁志、JPMJER1901)の支援を受けて実施されました。
用語解説
(注1)ヌクレオソーム
ヒストンタンパク質にDNAが巻き付いた安定な構造体(図1)。非常に長いゲノムDNAをコンパクトに収容できる一方で、巻き付いたDNAを読み取ることが困難になる。
(注2)クライオ電子顕微鏡
低温状態で凍結試料に電子線を照射し、原子レベルで生体分子の形状を観察することができる装置。試料を凍結することで、電子線によるダメージから生体分子を保護するとともに、溶液中でのタンパク質の構造が観察を可能にする。
(注3)RNAポリメラーゼII
DNAの塩基配列を読み取り、その相補的なRNAを合成する酵素。読み取りの間にDNA損傷を検出すると停止する。DNAに含まれる遺伝情報が機能するための必須のステップを担う。
アイキャッチ画像
雑誌名等
雑誌名:
Journal of Molecular Biology
論文タイトル:Structural basis of damaged nucleotide recognition by transcribing RNA polymerase II in the nucleosome
著者:Ken Osumi, Tomoya Kujirai, Haruhiko Ehara, Mitsuo Ogasawara, Chiaki Kinoshita, Mika Saotome, Wataru Kagawa, Shun-ichi Sekine, Yoshimasa Takizawa, Hitoshi Kurumizaka
DOI番号:10.1016/j.jmb.2023.168130
URL:
https://doi.org/10.1016/j.jmb.2023.168130
問い合わせ先
胡桃坂 仁志(くるみざか ひとし)
東京大学定量生命科学研究所 クロマチン構造機能研究分野 教授