発表概要
JST 戦略的創造研究推進事業の一環として、東京大学の深井 周也 准教授らは、パーキンソン病関連たんぱく質USP30とユビキチン鎖注1)が結合した状態の立体構造を決定し、そのユビキチン鎖切断メカニズムを解明しました。
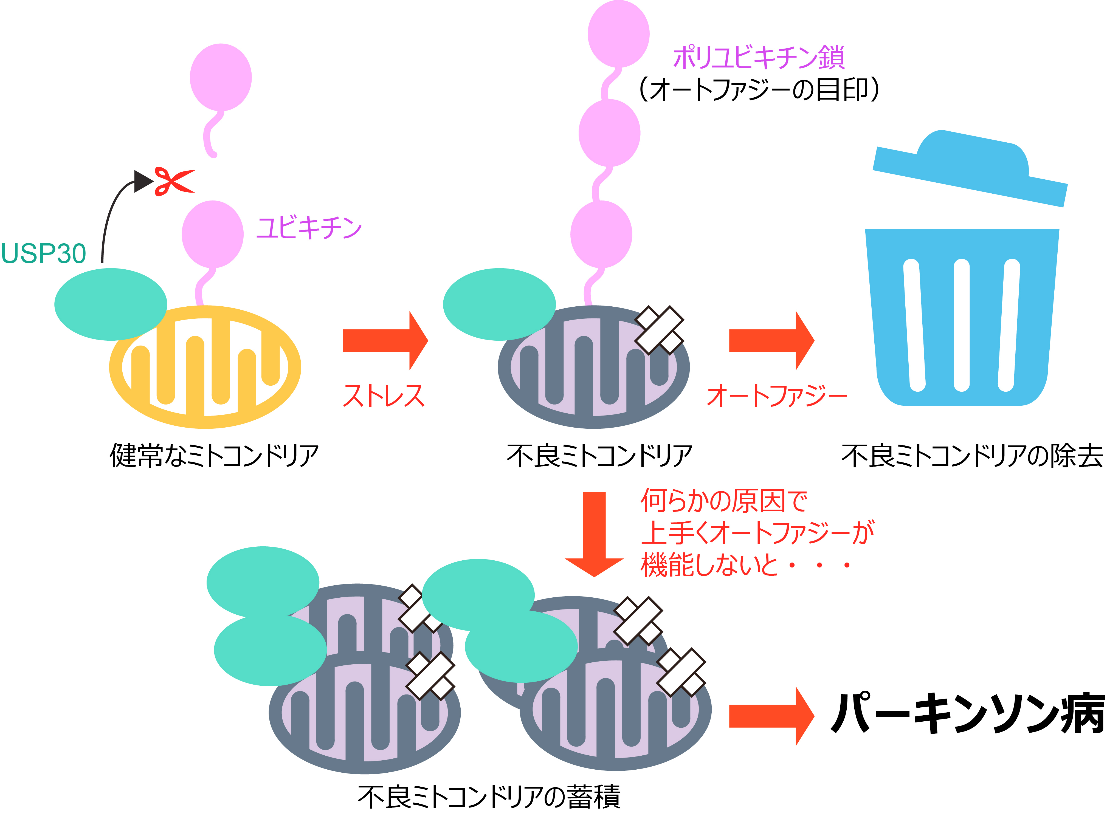
これまでの研究により、神経変性疾患であるパーキンソン病注2)の原因の1つに、神経細胞における不良ミトコンドリアの蓄積があることが分かっていました。通常の細胞では、健常なミトコンドリア注3)が不良ミトコンドリアになるとユビキチン鎖が付加され、それを目印としてオートファジー注4)による分解が行われます。一方、USP30は常にミトコンドリア外膜上に存在し、ミトコンドリア上のユビキチン鎖を切断除去することで、ミトコンドリアの過剰な分解が起きないように制御していると考えられています。しかし、USP30がどのようにしてユビキチン鎖の切断除去を行うのか、そのメカニズムは全く不明でした。
本研究グループは、USP30とユビキチン鎖との複合体の立体構造を高解像度で決定して切断メカニズムを明らかにしました。さらに、最先端の質量分析法を駆使して、USP30によるミトコンドリア上のユビキチン鎖の切断を解析しました。
USP30の阻害剤はパーキンソン病に対する創薬シーズとして注目されています。本研究で解明したUSP30の高解像度の構造情報は、阻害剤設計の重要な足がかりとなり、パーキンソン病の治療薬開発につながることが期待されます。
本研究は、東京都医学総合研究所の田中 啓二 所長らと共同で行ったものです。
本研究成果は、2017年9月25日(英国時間)に英国科学誌「Nature Structural & Molecular Biology」に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長兼所長)
研究課題名:「シナプス形成を誘導する膜受容体複合体と下流シグナルの構造生命科学」
研究代表者:深井 周也(東京大学 分子生物学研究所 准教授)
研究期間:平成24年10月~平成30年3月(予定)
JSTは本領域で、先端的ライフサイエンス領域と構造生物学との融合により、ライフサイエンスの革新に繋がる「構造生命科学」と先端基盤技術の創出を目指します。上記研究課題では、シナプス形成を誘導するたんぱく質複合体を解析することでシナプス形成のメカニズムを原子レベルの解像度で明らかにし、その情報に基づいてシナプス形成を制御する方法を開発します。
雑誌名等
雑誌名: Nature Structural & Molecular Biology(英国時間9月25日掲載)
論文タイトル: "Structual basis for specific cleavage of Lys6-linked polyubiquitin chains by USP30"
(USP30によるLys6結合型ポリユビキチン鎖特異的な切断の構造基盤)
著者: Yusuke Sato, Kei Okatsu, Yasushi Saeki, Koji Yamano, Noriyuki Matsuda, Ai Kaiho, Atsushi Yamagata, Sakurako Goto-Ito, Minoru Ishikawa, Yuichi Hashimoto, Keiji Tanaka and Shuya Fukai
DOI番号: 10.1038/nsmb.3469
問い合わせ先
<研究に関すること>
東京大学 分子細胞生物学研究所 蛋白質複合体解析研究分野
准教授 深井 周也(ふかい しゅうや)
<JST事業に関すること>
川口 哲(かわぐち てつ)
科学技術振興機構 戦略研究推進部
<報道担当>
科学技術振興機構 広報課