ヒストンシャペロンTAF-Iβが有する新規フォールドから規定されるシャペロン作用機構論の構築
- 本論文の背景
DNAは多数の塩基が長くつながった構造をしている。この形状のため、核の中にしまっておかれるためには適切な大きさに折りたたまれることになる。また、DNA上にある遺伝情報は、常時すべてが使われる訳ではないため、容易に間違った遺伝情報が読まれないように工夫されている。「折りたたまれている」「間違って読まれない」、これらのことを可能にしている主たる蛋白質が、ヒストンである。
ヒストンは、H1、H2A、H2B、H3、H4の5種類があり、このうちH1以外のヒストンがそれぞれ2個ずつ集まって、ヒストン八量体を形成している。ヒストン八量体の周囲を、146塩基対分のDNAが1.75周巻きつき、ヌクレオソームという構造体を形成する。ヌクレオソームが更につながった(一見ビーズが糸でつながれたように見える)構造をクロマチンと呼び、クロマチンが更に折りたたまれると、染色体と呼ばれることになる。光学顕微鏡で観察できる染色体は、遺伝情報が取り出しにくい凝縮した状態であるが、受精卵から細胞が増えながら変化していく発生段階や、脳、筋肉、血管などの組織を最終的に形成する細胞の分化段階では、凝縮した密の状態から、疎の状態へと構造が変換される必要が生じる(図1)。

図1.DNAから染色体にいたる凝集構造。DNAはヒストンやヒストン結合蛋白質と複合体を形成することで折りたたまれた状態(クロマチン構造)を形成している。遺伝子の発現や複製・修復などDNA上で起こる様々な現象に応じて、クロマチン構造が染色体のように高度に凝縮した状態からDNAを露出させる状態までダイナミックに変換される。
染色体の主要構成成分であるDNAとヒストンが、比較的単純なヌクレオソーム構造を形成していることが明らかにされたのは1974年、昨年ノーベル化学賞を受賞したR.Kornbergによってである(図2)。その後、前述したように、ヌクレオソーム構造が遺伝情報を読み取る遺伝子の転写やDNA複製など核内反応を抑える働きをしていることが分かり、ヌクレオソーム構造の変換がDNA上の遺伝情報を引き出すか否かの鍵を握る、つまり遺伝子発現のON/OFFスイッチの基盤になっていることが明らかにされてきた。したがって、染色体を構成する基本単位であるヌクレオソーム構造の変換機構を明らかにすることは、染色体の働きやそのメカニズムを理解する上で、最も重要な課題となった。
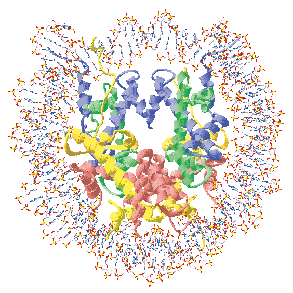
図2.ヌクレオソーム立体構造図。図中において青がヒストンH3、緑がヒストンH4、黄色がヒストンH2A、赤がH2Bを表している。H3, H4, H2A, H2Bが2分子ずつ集まったヒストン八量体の回りをDNAが巻きついている。この構造中では、H3-H3’相互作用が構造維持に重要な働きを担っている。
ヌクレオソーム構造の変換に大きな役割を果たすのが、ヒストンシャペロンと呼ばれる蛋白質群である。DNAがヒストンと結合してヌクレオソーム構造を形成する時、逆にDNAをヒストンから引き離して遺伝情報を含む塩基対に他の蛋白質が近づき易いようにする時、いずれの場合もいくつかのヒストンシャペロンと呼ばれる蛋白質が働くことが知られている(図3)。しかし、どのようにDNAやヒストンに働きかけるのか、その仕組みや具体的な役割は不明のままであり、その解明に研究競争が繰り広げられている。蛋白質の細胞内での機能を知るためには、その蛋白質の形を決める構造解析が必須である。私達は、これまで研究対象として扱ってきたヒストンシャペロンであるTAF-Iβの構造を明らかにすることで、ヌクレオソーム構造の変換とヒストンシャペロンの関わりを解明し、分子機構の理解に大きな前進が得られると考えた。
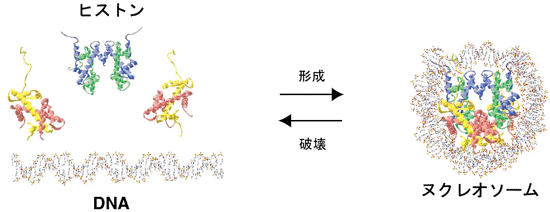
図3.ヌクレオソームの形成・破壊反応の模式図。ヌクレオソームはH3(青)-H4(緑)四量体1個とH2A(黄)-H2B(赤)二量体2個、そしてDNAから形成される。このヌクレオソーム形成・破壊反応の仲介役を行う因子がヒストンシャペロンである。
1997年にK.Luger, T.RichmondらによってヌクレオソームのX線結晶構造解析がなされ、ヒストンH2A, H2B, H3, H4が2分子ずつ集まったヒストン八量体の周りを、146塩基対からなるDNAが1.75周巻きついていることが明らかとなった(図2)。しかしながら、このヌクレオソーム構造がどのように形成され、必要に応じてどのようにほどかれるのかは、依然として謎に包まれたままである(図3)。本論文では、ヌクレオソームの形成・破壊に関与するヒストンシャペロンTAF-Iβについて構造解析と機能解析の両方を行い、ヒストンシャペロンが関与するヌクレオソーム形成・破壊機構の解明の糸口を得ることができた。
まず、精製したTAF-Iβを結晶化させ、X線結晶構造解析により立体構造を得た。TAF-Iβ単量体は、βシートとαへリックスからなる球型構造と、そこから突き出た長いαへリックスにより形成されている。2個の単量体それぞれから突き出したαへリックス間で相互作用が起こり、ヘッドフォン様の構造をとる二量体が形成される(図4)。球型構造が「耳あて」の部分、2本の相互作用しているαへリックスが2つの耳あてをつなぐ「背骨」の部分と考えるとわかりやすい。TAF-Iβは、この二量体を取っている時が構造的に安定であることが分かっている。
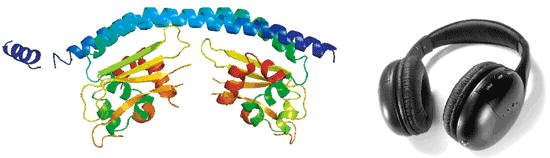
図4.今回、初めて明らかにされたヒストンシャペロンTAF-Iβの立体構造図(左)。ヘッドフォン(右)様の構造であることが分かる。「耳あて」の部分にあたるαへリックスとβシートからなる2つの球型構造が、「背骨」の部分にあたる長いαへリックスの束でつながった特徴的な構造をとっている。
今回の論文では得られたTAF-Iβの立体構造と、機能解析を組み合わせることにより、ヒストンシャペロンの作用機構の一端を明らかにしている。ヒストンシャペロンの研究では、これまで主にヒストンシャペロンがどのようにヒストンに作用するかが注目され解析されてきた。しかし、ヒストンシャペロンがDNAとヒストン間の相互作用を制御していると考えると、ヒストンに作用するのと同様に、DNAにも直接作用している可能性もある。そこで、ヒストンシャペロンTAF-IβとDNAとの相互作用を検定したところ、TAF-IβがDNAと直接相互作用することが確認できた。これは本論文により初めて明らかになった知見である。
また、TAF-Iβのどの分子表面がヒストンとの相互作用もしくはDNAとの相互作用に重要なのかを決定するために、アミノ酸変異を用いてその活性の変化を調べた。TAF-Iβの表面上に露になっている連続するアミノ酸3つずつをアラニン残基に置換する方法を利用し、変異体18種類を作製して、それぞれをほぼ純度100%近くまで精製した。野生型とこれらの変異体、それぞれのヒストンシャペロン活性を測定したところ、「耳あて」の部分の下面側から内側側面にかけて直線上に並んでいるアミノ酸に変異があると、ヒストンとの相互作用もDNAとの相互作用も劇的に低下することが分かった。これらの結果は、TAF-Iβは「耳あて」部分の下面でDNAおよびヒストンと相互作用し、その協調的作用によりヒストンシャペロン活性を担っていることを示している(図5)。これは、染色体の基本構成単位であるヌクレオソーム構造に対して、ヒストンシャペロンが働く様子を具体的に理解する上で、重要な知見である。
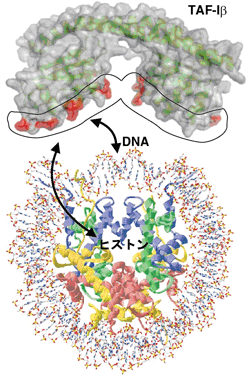
図5.TAF-IβのDNA及びヒストンとの相互作用表面。TAF-Iβは「耳あて」部分の底部(赤で示した分子表面)でDNA及びヒストンと相互作用することによってヒストンシャペロン活性を得る。
TAF-1βは癌との関連について多くの知見が蓄積されている。増殖している腎上皮細胞やWilms’ tumor癌細胞ではTAF-1βの発現が上昇していること、乳癌、胃癌、直腸癌、子宮癌の細胞もTAF-1βが正常細胞より多く存在していること、さらに白血病の要因因子であるHuman MLL (mixed lineage leukemia)と相互作用する蛋白質であることなどが分かっている。本論文で明らかになったTAF-Iβの立体構造やDNAやヒストンとの相互作用を皮切りに、さらなる作用機構の解明が行われることで、癌治療に新しいアプローチをもたらし、薬剤開発への発展も期待できるだろう。なお、TAF-Iβは、転写因子でしかも癌遺伝子さらには動脈硬化に関わるとされるKLF-5の活性を制御することを我々は明らかにしているので、そういった側面からも癌治療に新しいアプローチが出来ると考えられる。加えて、核内反応全てに関わる染色体の基本構成単位であるヌクレオソームに対するTAF-1βの作用を考えると、癌研究のみならず、様々な高次生命現象における応用研究のターニングポイントになるのではないかと考えている。
