発生分化構造研究分野は、真核生物における遺伝子発現制御機構の解明を目指し、反応の中心因子を進化的高保存因子と想定し、それらを独自の手法で機能未知因子として単離し、その機能解明を行った上で、生化学、分子生物学、遺伝学、構造生物学など手法に制限を加えず解析を進め、世界をリードする独自性の高い様々な概念を提示しています。
新たな概念の創出
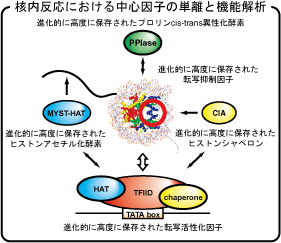
新規クロマチン因子の単離と機能解析
J.Biol.Chem., 272, 30595-30598 (1997)
Genes Cells, 5, 221-233 (2000)
Genes Cells, 5, 251-263 (2000)
Cell, 102, 463-473 (2000)
Proc.Natl.Acad.Sci.U.S.A., 99, 9334-9339 (2002)
Nature Struct.Mol.Biol., 11, 275-283 (2004)
Nature Struct.Mol.Biol., 13, 331-338 (2006)
Proc.Natl.Acad.Sci.U.S.A., 104, 4285-4890 (2007)
ヌクレオソームの半保存的複製モデル
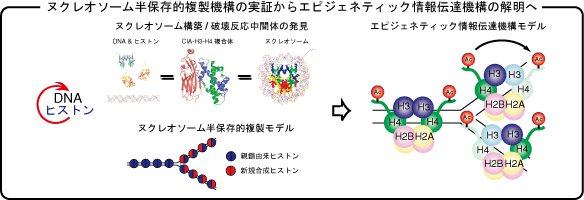
図はヌクレオソームの半保存的複製機構についての概念図を示しています。
ヌクレオソームの複製機構ではヌクレオソームの構成要素ヒストン八量体が無作為に分配されると教科書等には記述されていますが、当研究室では30年来安定であると考えられてきたヒストン(H3-H4)2四量体を二つのヒストンH3-H4二量体に分割する活性をCIAが有することを示しました。この知見から、ヌクレオソームはDNA同様、半保存的複製を行うことが予想されます。ヌクレオソームが半保存的に複製されるならば、図の右上に示すように、ヒストンの持ち合わせるエピジェネティック情報も親鎖ヌクレオソームから娘鎖ヌクレオソームへ均等に伝達されると考えられます。これらの結果により、エピジェネティクス最大の課題を解決することに至るのではないかと考えています。
Nature, 446, 338-341 (2007)
Negotiable border モデルの創出
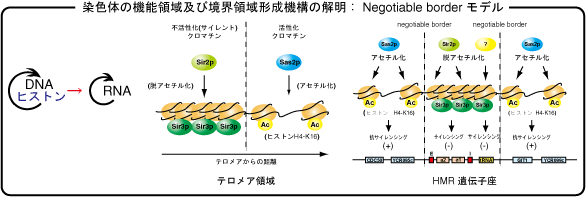
Nature Genet., 32, 370-377 (2002)
Genes Cells, 9, 499-508 (2004)
ヒストン点変異体の網羅的解析を通しての全核内DNA介在反応の解析
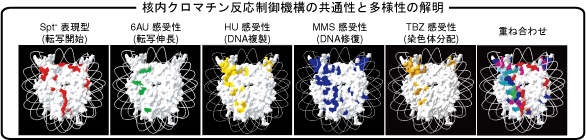
ヒストンはDNAとともに染色体の基本構造であるヌクレオソームを構成し、DNA上で起こる様々な反応の抑制因子として働いています。したがって、転写やDNA複製、DNA修復といったDNA上で起こる反応を理解するためには、ヒストン、特に反応が起こる過程で様々な因子と相互作用するヒストンの分子表面、がそれらの反応にどのように関与しているかを明らかにすることが必須です。しかし、1997年にヌクレオソームのX線結晶構造が報告されているものの、ヌクレオソームのどの分子表面がそれらのDNA上の反応に関与しているかは不明でした。
そこで当研究室はヌクレオソームの分子表面に位置する320箇所のアミノ酸残基ひとつひとつに対して出芽酵母の点変異体を作成し、転写開始、転写伸長、DNA複製、DNA二本鎖切断修復における機能欠損を検出する検定を用いて320個の点変異体の表現型を解析しました。その結果、それぞれの反応系で機能欠損を示す点変異体同定し、それぞれの反応系に関与するヌクレオソームの分子表面を決定しました。これにより、それぞれの反応系に共通に使われる分子表面がある一方、それぞれの反応系で使い分けられている分子表面が存在することを明らかにしました。Genes Cells, 12, 13-33 (2007)
