ヒストンシャペロンCIA/Asf1とヒストンH3, H4からなる複合体の構造と機能
- 本論文の背景
- 本論文の内容
生物の共通基本単位である細胞において、その構成成分の情報を担う遺伝子DNAは、ヒストンを代表とする様々な蛋白質と結合して染色体を形成している。光学顕微鏡で観察できる染色体は、遺伝子が働くことができない凝縮した状態であるが、受精卵から細胞が増えながら変化していく発生段階や、最終的には脳、筋肉、血管などの組織を形成する異なる様々な細胞が生じてくる分化段階では、染色体上の異なる位置にある様々な遺伝子が働くために、染色体はそのような凝縮した密の状態から、疎の状態へと構造が変換される必要がある。
1974年、染色体の主要構成成分であるDNAとヒストンが、比較的単純な基本単位であるヌクレオソーム構造を形成し、DNA上に繰り返し並んでいることが明らかにされた。この研究は転写酵素RNAポリメラーゼIIのX線結晶構造解析で昨年ノーベル化学賞を受賞したR.Kornbergによってなされ、このヌクレオソーム構造の発見により染色体の構造変換を伴って起こる遺伝子機能制御の根本的原理の追及が可能となった。
その後、ヌクレオソーム構造が転写、DNA複製など核内反応を抑える働きを持つことが明らかになり、ヌクレオソーム構造の変換が遺伝子DNAの持つ情報を引き出すか否かを決める、すなわち遺伝子発現のON/OFFのスイッチの根本的基盤になっていることが明らかにされてきた。従って、染色体を構成する基本単位であるヌクレオソーム構造の変換機構を明らかにすることは、染色体の持つ全ての働き及びそのメカニズムを理解する上で、最も重要な課題となった
1997年にK.Luger, T.RichmondらによってヌクレオソームのX線結晶構造解析がなされ、ヒストンH2A, H2B, H3, H4が2分子ずつ集まったヒストン八量体の周りを、146塩基対からなるDNAが1.75周巻きついていることが明らかとなった(図1)。しかしながら、このヌクレオソーム構造がどのように形成され、必要に応じてどのように破壊されるのかは現在に至るまで依然として謎に包まれたままであった。本論文では、ヒストンシャペロンCIAとヒストンH3, H4からなる複合体のX線結晶構造解析の結果(図2)、ヌクレオソーム内でヒストンH3同士の相互作用に用いられる分子表面をCIAが利用してヒストンH3と相互作用することにより、CIA-ヒストンH3-H4複合体を形成していること、すなわちヌクレオソーム構造変換反応の中間状態を取っていることを示唆する知見を得ることに成功した(図3)。このことにより、今まで全く知ることのできなかったヌクレオソーム構造変換制御機構、更には染色体構造変換制御機構について、解明の端緒となるモデルを提示することができた。
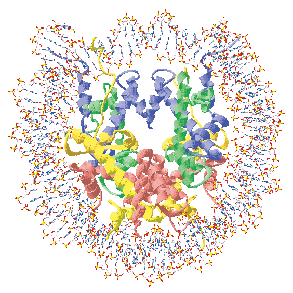
図1.ヌクレオソーム立体構造図。図中において青がヒストンH3、緑がヒストンH4、黄色がヒストンH2A、赤がH2Bをあらわす。H3, H4, H2A, H2Bが2分子ずつ集まったヒストン八量体の回りをDNAが巻きついている。この構造中では、H3-H3’相互作用が構造維持に重要な働きを担っている。
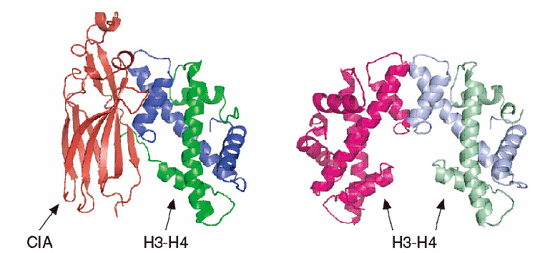
図2.CIA-ヒストンH3-H4複合体構造と、ヌクレオソーム構造中におけるヒストンH3-H4二量体間の相互作用の比較。ヒストンH3-H3’相互作用部位にCIAが相互作用し、CIAがヒストン同士の相互作用を防いでいることがわかる。
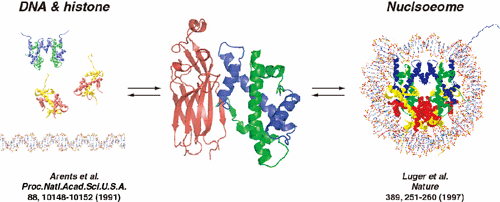
図3.CIA-ヒストンH3-H4複合体はヌクレオソーム構造の形成、破壊反応における中間体であると考えられる。
本論文ではそれ以外にも重要な点を明らかにすることができた。ヒストンの複数のアミノ酸残基は様々な外界の環境の変化や細胞の発生・分化状態に応じてアセチル化やメチル化など様々な化学修飾を受けている。このようにして決定された染色体の各領域におけるヒストンの化学修飾パターンが遺伝子発現パターンを決定していることが近年急速に多くの例で明らかになってきた。発生・分化に伴い、同じ遺伝子発現パターンを有する細胞が増えることから、この遺伝子発現パターンに関する情報が塩基配列に依らず親細胞から娘細胞へ伝達されていることが示唆されている。これは遺伝子の塩基配列によって決まるジェネティクスに対し、エピジェネティクスと呼ばれており、ヒトやマウスゲノムの全塩基配列が決定されたポストゲノム時代に入った現在も、依然として謎に包まれた最重要課題となっている。すなわち、このヒストンの化学修飾パターンがどのように親細胞から娘細胞へと受け継がれていくのか、が大きな問題となっている。従って、親細胞と同じ遺伝子発現パターンを持つ2つの娘細胞を作るには、DNA複製に伴って親DNA鎖が持つヌクレオソームにおける任意のヒストンの化学修飾パターンを維持しながら、2本の娘DNA鎖それぞれに新たなヌクレオソームを形成しなければならないと考えられる。しかし、この機構を考えるには大きな障壁が存在していた。
ヌクレオソームはヒストンH2A, H2B, H3, H4が2分子ずつ集まった構造であるため、ヒストンの化学修飾状態を維持するための最も単純なメカニズムとして考えられるのは、親DNA鎖が持つヌクレオソームからヒストンH2A, H2B, H3, H4を各々1分子ずつ2つの娘DNA鎖に分配する方法である(図4)。このメカニズムは、娘DNA鎖の持つヌクレオソームが親DNA鎖由来のヒストンと新規に合成されたヒストンからなっているという点で、DNAの半保存的複製のメカニズム(図5)に対応するともいえる。
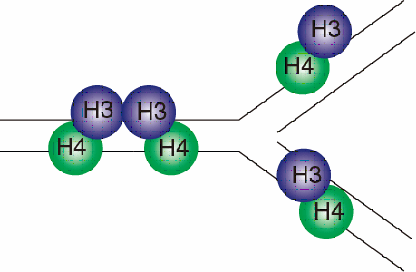
図4.ヌクレオソームの複製を考える上で、最も単純なヒストン分配のメカニズム。
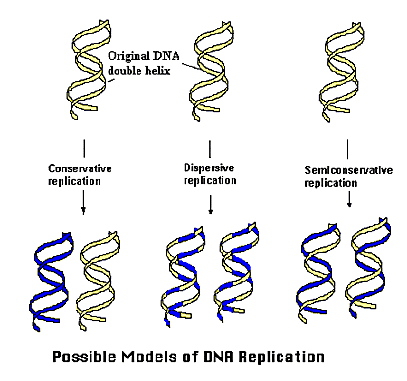
図5.DNAの複製機構のモデル。1953年にDNAの構造モデルがJ.WatsonとF.Crickによって提唱されることで、DNA複製機構として全保存的(Conservative)、分散的複製(Dispersive)、半保存的複製(Semi-conservative)のモデルが考え出され、1958年にM.MeselsonとF.Stahlによって半保存的複製メカニズムが正しいことが証明された。
ところが、ヒストンH3, H4はヒストンH3-H3’間の強い相互作用を基本とした四量体を形成していると長らく考えられていたため、ヌクレオソームの半保存的複製を考えることには無理があった。長い間信じられてきたその考えを変更するにはヒストン(H3-H4)2四量体を破壊する何らかの因子があることを証明し、しかもヌクレオソームの半保存的複製における作用メカニズムを明らかにしなければならない(図6)。更に、親DNA鎖の持つヌクレオソームにおける任意のヒストンの化学修飾パターンを娘DNA鎖の持つヌクレオソームへと伝達するためには、ヒストン化学修飾に対してまったく影響を与えずに、ヌクレオソーム構造の形成、破壊を行うことが可能な作用メカニズムであることが必要不可欠であった。
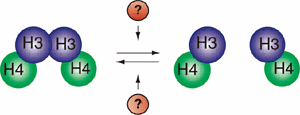
図6.ヌクレオソームの半保存的複製には、ヒストン(H3-H4)2四量体を破壊する因子が必要である。
本論文では、当研究室で世界に先駆けて単離、機能解析を進めてきたヒストンシャペロンCIAに上記の作用メカニズムを成り立たせる性質があることを明らかにしている(図2,6,7)。この結果は、1974年のR.Kornbergによるヌクレオソーム構造の発見、1997年のK.Luger, T.Richmondらによるヌクレオソームの立体構造解明以来、初めてヌクレオソーム構造変換機構モデルを提唱しうる解析を意味しており、染色体の構造変換制御の解明に大きく寄与しうるものである。また、1953年のJ.WatsonとF.CrickのDNAの半保存的複製モデルに対してのDNA-ヒストンからなるヌクレオソーム構造の半保存的複製モデルを提唱するものであり(図8)、染色体の機能変換制御、すなわちエピジェネティクス制御の仕組みを解明する第一歩の成果であるといえる(図7,9)。
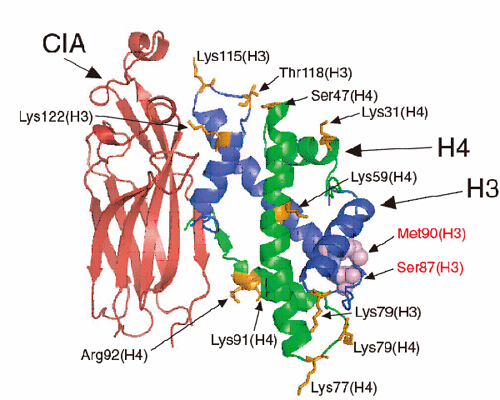
図7.今回の構造解析により、CIA-ヒストンH3-H4複合体構造中でヒストンH3及びH4の化学修飾残基が露出されていることが分かった。このことから、CIAはヒストンH3及びH4の化学修飾に対して影響を与えずに、ヌクレオソーム構造の形成、破壊を行うことが可能であることが示唆された。
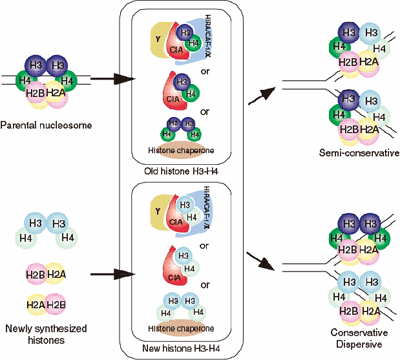
図8.今回の構造解析により、ヌクレオソームも半保存的に複製される可能性が示された。
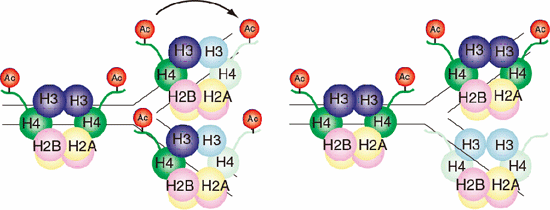
図9.親DNA鎖の持つヌクレオソームにおける任意のヒストンの化学修飾パターンが娘DNA鎖の持つヌクレオソームへと伝達される。
