 | ||

|
肝臓構成細胞と肝疾患各画像はクリックで拡大します。 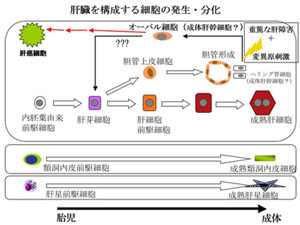 肝臓は体内最大重量をなす実質臓器であり、エネルギー代謝や有害物質の無毒化などの代謝中枢的な役割をはじめ、血清タンパク質や胆汁の産生、生体防御など、きわめて多岐に渡る生命維持に必須の機能を担う。肝臓は、その7割近くを切除しても再生可能なほど生体内では再生能力が高い臓器としても知られている一方、生体外では急速にその増殖能と機能を失うため、人工肝臓の作製が困難なものとなっている。
肝臓は体内最大重量をなす実質臓器であり、エネルギー代謝や有害物質の無毒化などの代謝中枢的な役割をはじめ、血清タンパク質や胆汁の産生、生体防御など、きわめて多岐に渡る生命維持に必須の機能を担う。肝臓は、その7割近くを切除しても再生可能なほど生体内では再生能力が高い臓器としても知られている一方、生体外では急速にその増殖能と機能を失うため、人工肝臓の作製が困難なものとなっている。肝臓は、胆汁の産生や各種物質の代謝などの肝臓としての主要な機能を担っている肝実質細胞(肝細胞)の他に、肝類洞内皮細胞、クッパー細胞、肝星細胞、ピット細胞、胆管上皮細胞、中皮細胞などの肝非実質細胞と呼ばれる多種の細胞群から構成される。生体において肝臓の恒常性が維持され、その機能が十分に発現されるためには、これらの細胞間での相互作用が重要であり、そのような細胞間ネットワークの破綻が病因及び病態形成に密接に関わることも明らかとなってきている。 肝臓の一部を切除した際の肝再生時には、肝臓は肝実質細胞や各種の肝非実質細胞がそれぞれ増殖することにより本来の大きさと機能を回復する。一方、肝実質細胞の増殖が阻害される状況や重篤な肝障害時においては、門脈域周辺から未分化性を有した特殊な細胞(マウスやラットでは「オーバル細胞」と呼ばれる)が出現し、これが肝実質細胞及び胆管上皮細胞に分化・増殖することにより肝臓の再生を行うことが知られており、再生医療の材料としても注目されている。しかしながら、その由来や性状、増殖・分化機構についてはよく分かっておらず、臨床応用の観点からもその解明が期待されている(右図)。 このように、肝臓の構成細胞の性状や相互作用の様態を明らかにすることは、未分化肝細胞の増殖・分化を制御するための手がかりを与えてくれるのみならず、 成体組織幹細胞の制御や臓器再生の普遍的な原理の理解、様々な肝疾患の原因究明や治療法の確立にも役立つと考えられる。 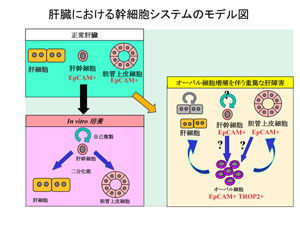 当研究室では、マウスの成体肝臓における組織幹細胞と考えられていたオーバル細胞の性状解析への足掛かりとして、その細胞表面マーカー分子の同定を試み、Epithelial cell adhesion molecule (EpCAM)およびTrop2を見出した(Okabe M, Development. 2009)。EpCAMは、正常(障害を受けていない)肝臓の胆管上皮細胞、および、肝障害時に出現するオーバル細胞での発現が確認された。一方Trop2の発現は、肝障害時のオーバル細胞にのみ特異的に認められた。また、抗EpCAM抗体を用いて成体肝臓より分取した細胞を培養すると、正常肝および障害肝のいずれからも、in vitroにおいて肝実質細胞及び胆管上皮細胞への分化能力を示す細胞が見出された。これらの結果から、Trop2がオーバル細胞特異的なマーカー分子であること、障害肝のみならず正常肝においてもEpCAM陽性細胞群の中に「肝幹細胞」としての性質を示す細胞が存在すること、逆に、オーバル細胞は真の幹細胞では無くtransit amplifying cellsに相当するものであること、が明らかとなった。
当研究室では、マウスの成体肝臓における組織幹細胞と考えられていたオーバル細胞の性状解析への足掛かりとして、その細胞表面マーカー分子の同定を試み、Epithelial cell adhesion molecule (EpCAM)およびTrop2を見出した(Okabe M, Development. 2009)。EpCAMは、正常(障害を受けていない)肝臓の胆管上皮細胞、および、肝障害時に出現するオーバル細胞での発現が確認された。一方Trop2の発現は、肝障害時のオーバル細胞にのみ特異的に認められた。また、抗EpCAM抗体を用いて成体肝臓より分取した細胞を培養すると、正常肝および障害肝のいずれからも、in vitroにおいて肝実質細胞及び胆管上皮細胞への分化能力を示す細胞が見出された。これらの結果から、Trop2がオーバル細胞特異的なマーカー分子であること、障害肝のみならず正常肝においてもEpCAM陽性細胞群の中に「肝幹細胞」としての性質を示す細胞が存在すること、逆に、オーバル細胞は真の幹細胞では無くtransit amplifying cellsに相当するものであること、が明らかとなった。オーバル細胞の性状と併せて、その発生や増殖・分化を制御する分子メカニズムについても徐々に明らかになりつつある。他の様々な組織幹細胞の系においてWnt/β-catenin経路が幹細胞の増殖や未分化性維持に重要な役割を果たしていることが知られている。オーバル細胞においても、このWnt/β-catenin経路の活性化が誘導されていることが我々も含めた複数のグループにより相次いで報告された(Itoh T, FEBS Lett. 2009)。我々はまた、オーバル細胞の誘導や増殖にFGFシグナルが関与する可能性を、最近見出している。FGFはオーバル細胞周囲の間葉系細胞から産生されてオーバル細胞に作用する、いわゆる「ニッチシグナル」としての役割を担うことが示唆されている。FGFシグナルの持つ生理機能や上述のWnt/β-catenin経路との相互作用などについて、成体肝臓への直接的遺伝子導入法やノックアウトマウスの系を駆使しながら精力的な解析を進めている。 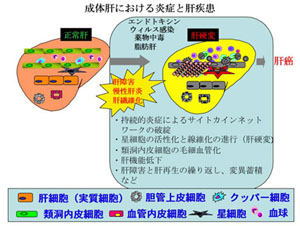 肝臓は解毒や外敵の侵入を防ぐ免疫の場としても生体の恒常性維持に役立っているが、時には過剰な免疫反応により肝自体の炎症が引き起こされる。肝炎の原因は肝炎ウィルスやアルコール摂取、薬物障害、脂肪肝など数多くあるが、慢性的な肝炎は肝の線維化をもたらし、肝硬変から肝癌へと進行するリスクファクターとなる。このような過程では恒常性を維持するためのサイトカインなどの液性因子のネットワークが破綻していると考えられる。我々はこれまでにOncostatin M(OSM)というサイトカインが肝発生に重要な作用を示すことを報告してきたが(肝発生のページを参照)、その受容体のノックアウトマウスが一部の代謝異常および肝炎・肝線維化を引き起こしやすいことを見出している。現在、このマウスをモデルとして肝構成細胞と肝炎・肝線維化との関わり、およびOSMが及ぼす作用(主に免疫系、代謝系)について解析を進めている。
肝臓は解毒や外敵の侵入を防ぐ免疫の場としても生体の恒常性維持に役立っているが、時には過剰な免疫反応により肝自体の炎症が引き起こされる。肝炎の原因は肝炎ウィルスやアルコール摂取、薬物障害、脂肪肝など数多くあるが、慢性的な肝炎は肝の線維化をもたらし、肝硬変から肝癌へと進行するリスクファクターとなる。このような過程では恒常性を維持するためのサイトカインなどの液性因子のネットワークが破綻していると考えられる。我々はこれまでにOncostatin M(OSM)というサイトカインが肝発生に重要な作用を示すことを報告してきたが(肝発生のページを参照)、その受容体のノックアウトマウスが一部の代謝異常および肝炎・肝線維化を引き起こしやすいことを見出している。現在、このマウスをモデルとして肝構成細胞と肝炎・肝線維化との関わり、およびOSMが及ぼす作用(主に免疫系、代謝系)について解析を進めている。最近、肝硬変患者に対する次世代の治療法として「自己骨髄細胞投与療法(ABMi療法)」が開発され、その有効性が明らかにされてきている。我々は、ABMi療法を開発した山口大学グループとの共同研究により、マウス肝硬変モデルを用いて投与骨髄細胞が肝線維化改善に寄与するメカニズムの詳細を細胞レベルおよび分子レベルで解明することにも取り組んでいる。これにより、より効果的な治療法の開発へと貢献したいと考えている。 |

|
|
| ||
|
| ||