研究概要
生物は環境からのさまざまなストレスに日々さらされて生きています。これらのストレスに対し、生物は、個体レベル、器官レベル、組織レベル、あるいは細胞レベルにおいてさまざまな適応反応を発達させてきました。
このうち進化的にも起源が古く、最も普遍的なのが細胞レベルにおける適応反応です。個々の細胞もストレス刺激によって引き起こされた変化や損傷に対して自らの恒常性を維持するための機構を備えています。
私達の研究グループでは、ストレス刺激に応答して活性化され適切な応答反応を引き起こす細胞内情報伝達経路に関する研究を行っています。細胞にとってストレスとなる刺激の多くが生物を問わず共通であることを反映して、ストレス応答情報伝達経路の多くは生物間で互いによく似ており、構造的にも機能的にも良く似た経路がヒトから酵母に至るまで保存されている場合もまれではありません。
そこで、強力な分子遺伝学的解析手法の完備した酵母をモデル系として用い、そこから得られた知見を直ちに哺乳類培養細胞を用いて検証するという方法で、種々のストレス応答情報伝達経路の解明に向けての研究を行っています。
Rim経路 TOR経路 HOG経路
Rim経路
出芽酵母の塩ストレス応答経路(Rim経路)の解析
酵母の塩(イオン)ストレス応答経路とその哺乳類相同経路の解析細胞膜を隔てたイオン勾配や膜電位の恒常性は、種々の生理機能の維持に必須です。そのため、細胞を取り巻く環境のイオン濃度の変化は、細胞に深刻なストレスとして作用します。
外界のイオン濃度の変化に抗して恒常性を維持しようとする塩(イオン)ストレス応答反応は、あらゆる細胞に普遍的に認められるストレス応答反応です。私たちは酵母をモデル系に、塩(イオン)ストレス刺激に応答して適応反応を引き起こす情報伝達経路を解明しようとしています。
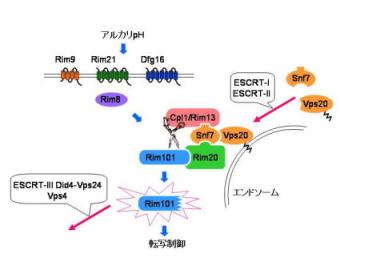
私たちは、このストレス応答に関与する情報伝達経路としてCpl1p-Rim101p経路を見出し研究を進めてきました。
この経路は、モジュレータープロテアーゼCpl1pと、転写因子Rim101pを主要な構成因子としています。Rim101pは、アルカリストレスに応答してC末端側にある制御領域がプロセシングを受けて除かれ、これにより転写因子として活性化されます。このプロセシングがCpl1pに依存して起こることから、アルカリストレス→Cpl1p活性化→Rim101pプロセシングという情報伝達経路を構成していると考えられます。
プロセシングにより、Rim101pの局在が細胞質から核へと変化し、このことが転写因子としての活性化に寄与していることを最近見出しました。また、このプロセシングは、Cpl1p以外にも、Rim8p、Rim9p、Rim20p、Rim30pのいずれかを欠損すると起こらなくなることから、これらの因子もまたCpl1p-Rim101p経路を構成していると考えられます。
現在、これらの因子の作用機構について研究を進めています。この経路は、塩ストレスに対する応答反応にも重要な役割を果たしています。Rim101pは、塩ストレスに応答してカルシニューリン(Ca2+・カルモジュリン依存性プロテインホスファターゼ)による脱リン酸化を受け活性化されます。
また、Cpl1pのホモログをヒトとマウスから単離しており、これを手がかりに哺乳類の相同経路についても研究を進めています。
TOR経路
栄養源感知に関わるTOR(Target of Rapamycin)経路の解析
細胞増殖においては、細胞の成長と分裂とは協調的に行われる必要がある。そのため、細胞は常に外界の栄養状態を検知し、細胞増殖を完遂するのに十分なタンパク質合成を行うことが可能かどうかを判断している。周囲の栄養源が枯渇している場合は、細胞は速やかにタンパク質合成を抑え増殖を停止する。
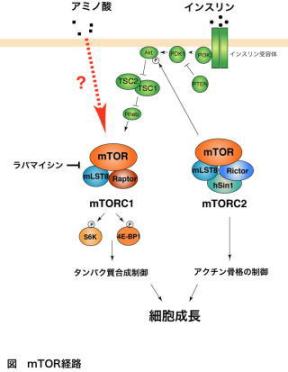
このような外界の栄養源感知において主要な働きをしていると考えられている情報伝達因子がTOR(Target of Rapamycin)とよばれるタンパク質キナーゼである。TORは、T細胞の増殖活性化を阻害する作用を持つ免疫抑制剤ラパマイシンの細胞内標的分子として同定されたタンパク質であり、酵母からほ乳類に至るまで広く保存されている。
ほ乳類TOR (mammalian TOR, mTOR)経路はアミノ酸やグルコースなどの栄養源により活性が制御されている。mTORはp70 S6キナーゼや4E-BP1といった翻訳開始に関与する分子のリン酸化を通してタンパク質合成を制御し、細胞の成長(大きさ)を制御している。
またmTOR経路はインスリンなどの成長因子、さらには低酸素、ATP枯渇など細胞のさまざまな状態によっても制御を受けている。このようなmTOR経路の破綻は癌や糖尿病をはじめとした種々の病気と密接に関わっていると考えられており、実際、既にラパマイシンは固形癌に対する抗癌剤としても臨床応用が進められている。
さらに、最近の研究からmTORは細胞内で独立な2つの複合体を構成しそれぞれ異なる機能を担うことが明らかにされ、mTORのさらなる多彩な役割が浮かび上がるなど、mTORを中心としたシグナル伝達経路はますます注目を浴びている。これまでの精力的な研究から、インスリンなどの成長因子やグルコース、低酸素、ATP枯渇によるmTOR経路の活性制御機構については徐々に明らかになりつつある。
一方、mTOR経路の中心的な役割と考えられているアミノ酸感知の分子機構については未だにあまりよくわかっていない。また、mTOR自身のキナーゼ活性制御機構についてもわかっていない点が多く残されており、これらの解明はmTORシグナル伝達経路における中心的な課題の1つといえる。
酵母にもTORの相同タンパク質Tor1p/Tor2pが存在し、哺乳類のTORと同様に栄養源の感知に重要な働きをしていることが分かっている。TOR自体の発見やTORの複合体構成をはじめとした多くの知見はほ乳類に先行するかたちで酵母において明らかにされており、酵母でのTOR経路の解析から得られる知見はほ乳類mTOR経路の解明にとっても有益であると考えられる。
HOG経路
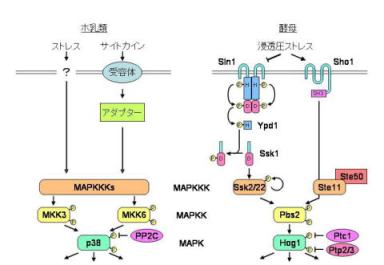
ストレス応答性MAPキナーゼ経路(出芽酵母HOG経路・哺乳類p38経路)の制御機構の解析
哺乳類細胞が、浸透圧や紫外線、熱、放射線、酸化、重金属などのストレス刺激にさらされると、ストレス応答性MAPキナーゼ経路と呼ばれる情報伝達経路が活性化され、生理的応答反応を引き起こすことが知られています。またこの経路は、炎症性サイトカインによっても活性化され、経路の過剰な活性化は、難病も含めた種々の炎症性疾患や、敗血症ショック、卒中、慢性循環器障害、免疫疾患、癌などの病理的反応にも深く関わっています。
サイトカインに応答してこの経路が活性化される機構については、サイトカイン受容体に結合するアダプター分子がMAPキナーゼキナーゼキナーゼ(MAPKKK)を直接活性化することがいくつかの例で報告されています。これに対し、ストレス刺激によってこの経路が活性化される機構については、不明な点が多く残されています。細胞が上に挙げたような物理的変数をどのように検知するかという問題は、増殖因子やホルモンの受容のようにリガンドと受容体の特異的結合に還元することができない、新しい問題であると言うことができます。
哺乳類ストレス応答性MAPキナーゼ経路と相同な経路が酵母にも存在し、やはり浸透圧ストレスに応答して活性化されます。私たちは、この酵母ストレス応答性MAPキナーゼ経路(HOG経路)を制御する主要な因子を同定し、その作用機構を明らかにしてきました。
浸透圧センサーとしては全く構造の異なる2つの経路が存在しています。
一方のSln1p-Ypd1p-Ssk1p経路は、バクテリアに特有の情報伝達機構であると考えられていた二成分情報伝達系(two-component system)を構成していました。これは真核生物における最初の完全な二成分情報伝達系の報告でもありましたが、さらにこの系が第3のコンポーネントも含んだ複合型で、二段階のHis-Aspリン酸リレーを特徴としていることを明らかにしてきました。最近になって同様な構成を持つ二成分情報伝達系が高等植物のホルモンや環境情報の情報伝達経路で広く機能していることを示す状況証拠が報告され、この経路が良いモデル系になると期待されます。
もう一方のSho1p経路は、センサーSho1pのSH3ドメインを介してMAPキナーゼキナーゼ(MAPKK)であるPbs2pを細胞膜にアンカーすることで機能します。これら2つの浸透圧センサーが浸透圧ストレスを検知する分子機構に関して研究を進めています。
また、酵母から得られた知見をもとに、哺乳類ストレス応答性MAPキナーゼ経路の新たな制御機構についても研究を進めています。酵母を用いた解析は、哺乳類ストレス応答性MAPキナーゼ経路の研究に有用なツールも提供してくれます。例えば、酵母の変異株を機能相補できるcDNAをスクリーニングすることで哺乳類細胞の新しい調節因子を単離することができます。
ホームへ戻る
Copyright (C) 2008 Maeda Laboratory,Institute of Molecular and Cellular Biosciences, The University of Tokyo. All Rights Reserved.