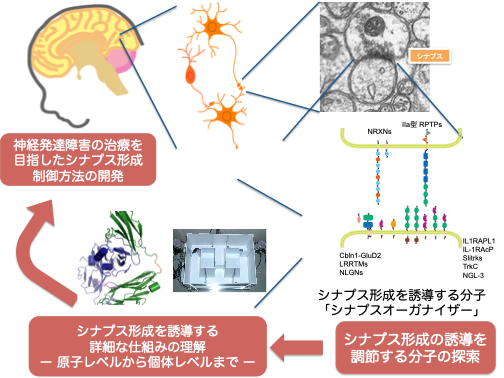
研究プロジェクト – 細胞機能を原子のレベルで理解する
中枢シナプス形成を誘導する膜受容体複合体(シナプスオーガナイザー)と下流シグナル複合体の立体構造解析と機能解析によって,シナプス形成を誘導するメカニズムを原子の解像度で明らかにし,さらに,シグナル伝達を調節するペプチドや低分子化合物の探索と疾患モデルマウスの行動への影響を解析することで神経発達障害への創薬標的を提示する研究を信州大学と富山大学の医学部と協力して進めています.
参考文献:Uemura et al., Cell, 2010; Yoshida et al., J. Neurosci., 2011, 2012; Yamagata et al., Nat. Commun., 2015; Yamagata et al., Sci. Rep., 2015; Goto-Ito et al., Nat. Commun., 2018; Yamagata et al., Nat. Commun., 2018a; Yamagata et al., Nat. Commun., 2018b; Wakita et al., Nat. Commun., 2020
また,神経細胞が機能する上で重要な膜タンパク質や脂質の細胞内輸送に関わるタンパク質複合体の立体構造解析と機能解析も行っています.
参考文献:Fukai et al., EMBO J., 2003; Sato et al., Structure, 2007; Sato et al., Proc. Natl. Acad. Sci. U.S.A., 2007; Yamashita et al., Nat. Struct. Mol. Biol., 2010; Yamagata et al., Genes Cells, 2010; Kubota et al., J. Mol. Biol., 2012; Kimura et al., Sci. Rep., 2016; Chen et al., Sci. Rep., 2017; Goto-Ito et al., Sci. Rep. 2017; Goto-Ito et al., Life Sci. Alliance, 2019; Shirakawa et al., EMBO J., 2020
Structural neuroscience
Ubiquitin signaling
ユビキチンは76アミノ酸残基からなる小さなタンパク質で,プロテアソームによるタンパク質分解シグナルとしての機能が有名ですが,タンパク質分解以外にも様々な細胞機能の制御シグナルとしてはたらくことが近年の研究により明らかになっています.ユビキチンは自身のリジン残基またはN末端のメチオニン残基(M1)とC末端のグリシン残基(G76)がイソペプチド結合あるいはペプチド結合を介してつながることでユビキチン鎖を形成しますが,48番目のリジン(K48)を介してつながったユビキチン鎖がプロテアソームによる分解シグナルとしてはたらくのに対して,M1やK63を介してつながったユビキチン鎖(M1鎖,K63鎖)はプロテアソームに依存しないシグナルとしてはたらきます.私たちは,M1鎖やK63鎖が重要な役割を担っているDNA損傷応答や炎症シグナルなどに注目し,そのシグナル制御メカニズムを立体構造解析と機能解析により明らかにしています.DNA損傷や炎症は細胞のがん化に非常に密接に関わっており,得られた知見をもとにがん抑制のための創薬基盤の提示を進めています.
参考文献: Sato et al., Nature, 2008; Sato et al., EMBO J., 2009a; 2. Yoshikawa et al., FEBS Lett., 2009; 3. Sato et al., EMBO J., 2009b; 4. Sato et al., PNAS, 2011; Sato et al., J. Biol. Chem., 2012; Sato et al., Nat. Struct. Mol. Biol., 2015; Toma et al., PLoS One, 2015; Sato et al., Nat. Struct. Mol. Biol., 2017; Takahashi et al., Nat. Commun., 2018; Okatsu et al., Sci. Rep., 2018; Takahashi et al., Nucleic Acids Res., 2019; Sato et al., Nat. Commun., 2019