研究紹介
Research projects
核内受容体研究は、内因性リガンドの同定に加え、核内受容体のリガンド結合領域における結晶構造の解明、転写制御に関与する共役因子の同定など、急速な進展を見せており、核内受容体を標的とした創薬化学の拡充は臨床応用の面からも強く求められている。
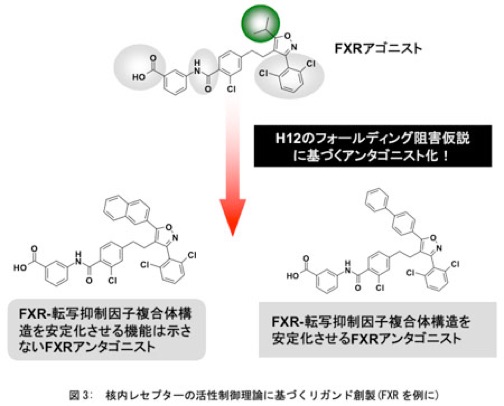
本研究室では、核内受容体の転写活性化における重要構造単位であるヘリックス12に対して、受容体アンタゴニストの結合様式が"Folding inhibitor"と"Misfolding inducer"の2群に大別できることを提案している。これに基づいた構造展開を行い、コレステロール・中性脂質代謝に重要な核内受容体であるファルネソイドFXRのアゴニストを、構造修飾によりアンタゴニストへと機能転換することに成功した。
同時に、我々が提唱した核内受容体の“リガンドスーパーファミリー概念”を踏まえ、受容体の各サブタイプに対して、同一の基本骨格からなるリガンド群の創製が可能であろうと考えた。本概念の適応として、ペルオキシソーム増殖剤応答性受容体(PPAR)の特徴的サブタイプ選択的リガンド創製を実施している。
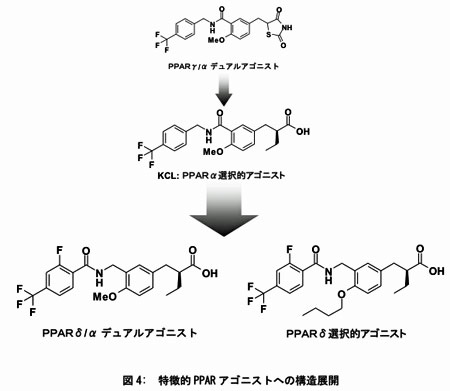
PPARは臨床適用されている高脂血症薬フィブラート類や、糖尿病治療薬であるグリタゾン類の医薬分子標的であり、現在最も注目を集めている核内受容体の一つである。PPARの合理的リガンド設計および創製は21世紀における医療上の急務課題である“メタボリックシンドローム”治療薬創製に直接結びつくものである。
我々が開発したPPARα選択的アゴニストの基本骨格である2-アルコキシベンズアミド構造をスキャフォールドと位置づけ、PPARα,δデュアルアゴニスト、さらにはPPARδ選択的アゴニストの創製に成功した。特に後者は、これまでに報告されている最強のアゴニスト以上の活性を有している。PPAR リガンド創製においても論理的な設計により、狙った活性を有する化合物のピンポイント創製のアプローチが十二分に機能した。
核内受容体リガンドの医薬応用は、言わば“遺伝子発現制御剤”という新たな医薬カテゴリーの確立に繋がり、小分子による遺伝子治療法の開発とも言える。
-
核内受容体の活性制御理論に基づく精密リガンド設計
13/12/14
